#本文由作者授权发布,未经作者许可,禁止转载,不代表IPRdaily立场#
来源:IPRdaily中文网(iprdaily.cn)
作者:Jack 企业专利观察
原标题:国内首仿药挑战诺华美国专利!诺华已展开反击
IPRdaily消息:6月19日,苏州晶云药物科技股份有限公司的科创板上市申请正式受理。招股书中,苏州晶云披露了全资子公司科睿思首仿药挑战诺华重磅药物的最新进展。

6月19日,苏州晶云药物科技股份有限公司(简称”苏州晶云“)的科创板上市申请正式受理。
招股书中,苏州晶云披露了全资子公司科睿思首仿药挑战诺华重磅药物的最新进展。
瑞士诺华公司(Novartis)已经在2019年10月17日在美国特拉华州联邦初级法院对包括科睿思在内的15位被告提起诉讼,主张在其拥有的专利号为US8,101,659、US8,796,331、US8,877,938及US9,388,134的美国专利(四项专利合称“原研专利”)到期前,包含科睿思在内的15位被告提交的关于沙库巴曲缬沙坦钠片的首仿药申请,寻求商业生产、使用、销售、许诺销售或进口沙库巴曲缬沙坦钠片的行为,构成对诺华原研专利的侵权。
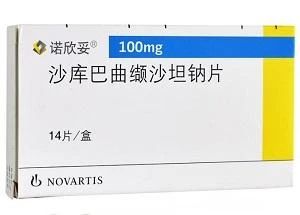
诺华原研药Entresto®沙库巴曲缬沙坦钠片是一款抗心衰的重磅药物,2015年7月7日被美国FDA首次批准上市,是诺华开发的全球首个血管进账素受体脑啡肽酶抑制剂,2019年全球销售额17.26亿美元。
为什么要挑战?挑战成功的首仿药有180天红利期
美国1984年9月24日颁布的药品价格竞争与专利期补偿法(又称Hatch-Waxman法案),开创了仿制药的现代审评体系,同时对药品的专利法也做出了重大的更改,从而推动了美国仿制药快速发展。美国首仿药的概念也起源于此。
根据美国相关法律规定,持有新药批件持有人,可以在FDA的橙皮书上列出新药的相关专利。根据Hatch-Waxman法案,如果仿制药申请人在橙皮书中参比药物的专利期没有届满前提出仿制药上市申请,则需要提交Paragraph IV(Paragraph IV certification)声明,即主张相关原研专利是无效的,或者其制造、使用或销售所提交申请的药品不会侵犯相关原研专利的声明)。
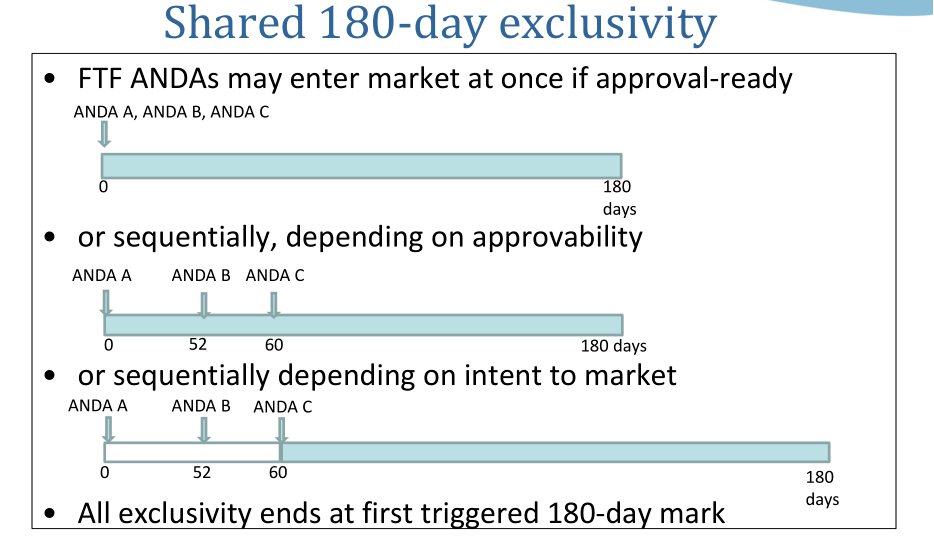
该法案规定,在“专利无效或者批准正在申请的药物不会侵犯专利”的情况下,第一个向美国FDA递交ANDA、并含有Paragraph IV声明的仿制药申请者,如果专利挑战成功,则FDA将给予180天的市场独占期。
为了鼓励仿制药企积极挑战原研药专利,在这180天内,FDA不再批准其他的ANDA持有人上市,而获得市场独占期的仿制药的定价可以高达原研药的94%,以弥补其在专利挑战时消耗的诉讼费用,并快速地收回成本,由于美国的药品价格完全通过市场竞争决定,政府不进行干预。完全市场化的价格形成机制使得竞争格局成为最重要的价格决定因素,新进入者都将以价格的牺牲来换取市场份额的提升,因此是否获得180天市场独占期对收益可以产生非常大的区别。
这个180天的市场独占期对于仿制药企业来说非常关键。如果不发起专利挑战,仿制药企业只能等新药橙皮书中所列的所有专利都过期之后,方能获批上市,此时的市场可能已经被原研药厂和首仿药厂蚕食殆尽。因此仿制药企业都很关注在原研药上市满4年后的首仿日(NCE-1日)提交挑战声明的申请,以期能够独享或共享这180天市场独占期。
科睿思就是在诺华Entresto®上市四年后的首仿日到来那天,于2019年7月8日成功向美国FDA提交了针对原研药Entresto®的首仿申请,科睿思作为沙库巴曲缬沙坦钠片的仿制药申请人提出了Paragraph IV声明,主张沙库巴曲缬沙坦钠片的相关原研专利是无效的,或者其制造、使用或销售所提交申请的药品不会侵犯相关原研专利。
诺华原研药Entresto®采用了两种活性成分形成的共晶晶型,并都申请了专利,该共晶专利在中国和美国将分别于2026年和2027年过期,这是科睿思(苏州晶云)首仿药开发及专利挑战的关键壁垒。
但据苏州晶云披露,晶型专利是仿制药开发的最大壁垒之一,创新晶型技术开发能突破该壁垒,将是尽早将仿制药成功上市的关键。其利用自身技术开发出创新共晶晶型,突破了诺华共晶晶型专利壁垒。
目前该申请正处在审批阶段。若该首仿项目成功获批,则可在诺华Entresto®晶型专利在2026年和2027年过期前提前上市,并与其他获批该品种首仿药的企业分享180天的市场独占期。180天市场独占期内,仅允许原研药及首仿药上市销售,市场竞争相对较低,首仿药从而可能获取较高的市场份额。180天市场独占期过后可能有其他创新晶型的仿制药上市,但一般而言,此时首仿药以其市场先发优势仍有可能享受较多的市场份额并保持稳定的销售。
这已不是苏州晶云第一次参与挑战美国首仿药
苏州晶云是中国首家专注于新药晶型研发的CRO(Contract Research Organization合同研究组织)公司。CRO企业主要提供从药物发现、到临床试验等各个环节服务的专业机构,承担某些药物研制试验和申报注册的工作任务,主要服务于新药上市及之前的阶段。
截至2019年12月31日,苏州晶云拥有34项已授权的国内专利(其中发明专利30项)和80项已授权的境外专利。
据其招股书披露,在挑战诺华之前,苏州晶云就曾参与过对强生等公司研发的Imbruvica®依布替尼胶囊的美国首仿申请。
Imbruvica®依布替尼胶囊是由强生公司和Pharmacyclics,Inc.(2015年5月被艾伯维收购)联合开发的全球首个上市的BTK抑制剂,用于套细胞淋巴瘤、慢性淋巴细胞白血病小淋巴细胞淋巴瘤患者的治疗。
该原研药于2013年11月在美国获批上市,2017年8月在中国获批上市。该原研药化合物和晶型的美国专利分别将在2027年11月和2033年10月过期,相差近6年时间。
苏州晶云针对该原研药的创新晶型专利(US9751889)于2017年9月获得美国专利局授权,这意味着相较于普通仿制药,采用该创新晶型技术的合作伙伴可将其开发的仿制药提前6年推向市场。
2015年,公司将该创新晶型专利及技术许可给西班牙知名原料药公司Esteve Quimica, S.A.,以支持其开发对应的创新晶型原料药。利用Esteve Quimica, S.A.供应的创新晶型原料药,两家国际仿制药公司开发出针对Imbruvica®的首仿药,于2017年11月13日成功向美国FDA提交首仿申请。
诺华对科睿思(苏州晶云)专利挑战的反击和影响
FDA在受理了科睿思的首仿药上市申请后,科睿思已根据相关法律规定向诺华发出了书面通知,载明其已申请沙库巴曲缬沙坦钠片首仿药上市的事实和法律依据等。
诺华在收到科睿思的通知之日起45日内提起了诉讼。诺华的诉讼请求具体包括:
(1)判决科睿思提交首仿药申请侵犯了其原研专利;
(2)颁发永久禁令,禁止科睿思及其高管、代理、律师、雇员等人员在原研专利到期(含专利延长期)前于美国境内参与商业制造、使用、销售、许诺销售,或向美国进口科睿思首仿药申请项下的产品;
(3)裁定原研专利到期前(含专利延长期),科睿思的首仿药申请不得审批通过;
(4)判决参与商业制造、使用、销售、许诺销售或进口科睿思首仿药申请项下产品构成对原研专利的直接侵权、间接侵权或帮助侵权;
(5)科睿思应当对原研专利的直接侵权、间接侵权或帮助侵权承担赔偿责任;
(6)判决由科睿思承担诺华的律师费;
(7)判决由科睿思承担诺华因本诉讼产生的支出和费用;
(8)其他法院认为公正恰当的救济。
2020年1月7日,科睿思提交了答辩状。
根据美国的相关法律规定,如新药批件持有人和专利所有权人在收到通知的45日内提起诉讼,FDA的审批将自动中止,除非特定情形发生(如法院判决不存在侵权行为或原研专利无效),否则FDA在30个月内不得批准首仿药申请。
鉴于这30个月的时间对于新药批件持有人和专利所有权人的价值,新药批件持有人和专利所有权人几乎都会在45日的期限内提起诉讼。
因此,该类诉讼属于新药批件持有人和专利所有权人为了延缓首仿药申请的获批而进行的战略性诉讼。
目前该专利诉讼处于早期阶段,尚未进入证据调查阶段。根据代理科睿思的美国律师事务所Parker Poe出具的法律意见,Parker Poe认为如果法院获得全部的相关信息,法院应会作出支持科睿思的判决。如果科睿思被判决败诉,诺华最可能采取的救济手段是禁止科睿思的产品在原研专利到期前获批上市。
值得注意的是,此次科睿思(苏州晶云)对诺华首仿药挑战,还联合了其它机构一起分担诉讼风险。
科睿思与Harman Finochem Limited、Sparta SPV,LLC在2019年12月26日签订《开发、许可和商业化协议》:约定科睿思、Harman Finochem Limited共同将其沙库巴曲缬沙坦钠片项目的47.5%收益转让予Sparta SPV,LLC,SpartaSPV,LLC向科睿思及Harman Finochem Limited支付相应对价。
科睿思就前述诺华诉讼发生的诉讼费用(不超过350万美元)和上诉费用(不超过40万美元),将由Sparta SPV,LLC先行承担。
未来沙库巴曲缬沙坦钠片上市销售的收益,优先分配给Sparta,以补偿其实际承担的诉讼费用、上诉费用和为本次交易发生的费用(不超过410万美元),然后再按比例向科睿思、Harman Finochem Limited和Sparta SPV,LLC三方分配。
来源:IPRdaily中文网(iprdaily.cn)
作者:Jack 企业专利观察
编辑:IPRdaily王颖 校对:IPRdaily纵横君

「关于IPRdaily」
IPRdaily是具有全球影响力的知识产权媒体,致力于连接全球知识产权与科技创新人才。汇聚了来自于中国、美国、欧洲、俄罗斯、以色列、澳大利亚、新加坡、日本、韩国等15个国家和地区的高科技公司及成长型科技企业的管理者及科技研发或知识产权负责人,还有来自政府、律师及代理事务所、研发或服务机构的全球近100万用户(国内70余万+海外近30万),2019年全年全网页面浏览量已经突破过亿次传播。
(英文官网:iprdaily.com 中文官网:iprdaily.cn)
本文来自IPRdaily中文网(iprdaily.cn)并经IPRdaily.cn中文网编辑。转载此文章须经权利人同意,并附上出处与作者信息。文章不代表IPRdaily.cn立场,如若转载,请注明出处:“http://www.iprdaily.cn/”

 共发表文章
31245篇
共发表文章
31245篇- 我也说两句
- 还可以输入140个字