没收到验证邮件?请确认邮箱是否正确或 重新发送邮件
#本文仅代表作者观点,不代表IPRdaily立场#
“一起药品发明专利权无效宣告请求行政纠纷案。”
专利法规定,权利要求书应当以说明书为依据,清楚、简要地限定要求专利保护的范围。在实践中,有不少专利的权利要求超出了说明书公开的范围,导致被宣告无效。近日,北京知识产权法院审理了一起药品发明专利权无效宣告请求行政纠纷案,下面就跟随小知一起了解一下药品专利中权利要求能否得到说明书支持的判断吧~
案情简介
原告拥有专利号为200680018223.4的发明专利(以下简称该专利),第三人认为该专利权的授予不符合专利法规定,于是向被告国家知识产权局提出专利权无效宣告请求,被告经审查做出无效宣告请求审查决定(以下简称被诉决定),认定该专利的权利要求1-19均不符合专利法第二十六条第四款的规定。
原告不服被诉决定,向北京知识产权法院提起行政诉讼,认为该专利并未违反专利法第二十六条第四款的规定。
法律分析
北京知识产权法院经审理认为:本案的争议焦点为该专利的权利要求是否符合专利法第二十六条第四款的规定。
作为一新型非典型抗精神病药,lurasidone是该专利的有效成分,该专利权利要求1为:一种口服制剂,该制剂含有通式(1)所示的N-[4-[4-(1,2-苯并异噻唑-3-基)-1-哌嗪基]-(2R,3R)-2,3-四亚甲基-丁基]-(1’R,2’S,3’R,4’S)-2,3-双环[2,2,1]庚烷二酰亚胺·盐酸盐(lurasidone),预糊化淀粉,水溶性赋型剂和水溶性聚合物粘合剂;其中,每片中lurasidone的含量为10-160mg,所述制剂中lurasidone含量为20%-45%(wt/wt),并且所述预糊化淀粉的混合量为制剂重量的10%-50%(wt/wt)。
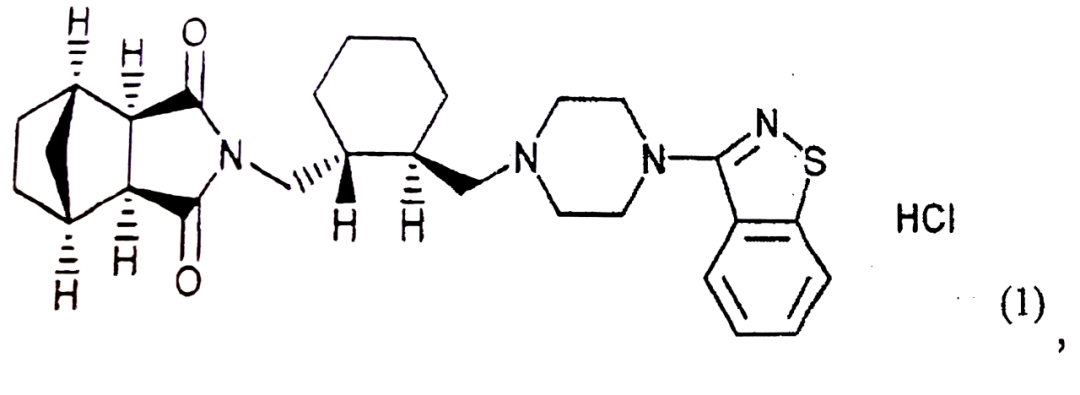
lurasidone通式
该专利说明书第[0013]段表明,在现有技术下,当病人需要摄入较高剂量lurasidone时,只能服用双倍量或更多lurasidone含量较低的制剂,这会对病人造成负担,为此急需对该方法进行改进。该专利的制剂可以提供一种具有更高含量lurasidone的口服制剂,减小病人的负担。
同时,说明书第[0008]段载明
“本发明提供一种活性成分含量增加的口服制剂,该制剂的溶出特性与每片中活性成分含量较低的多药片的溶出特性相似”。
而其中“活性成分含量较低的多药片”作为现有技术,可以提供范围为5mg-40mg lurasidone/片相同溶出特性(见附图1)的口服制剂。故此,该专利的发明目的实际上是提供一种高含量lurasidone (如80mg以上)的口服制剂,通俗地讲,当该专利药剂中lurasidone 含量为80mg时,其药效相当于现有技术中lurasidone 含量为40mg药剂的两倍,简言之,即实现“一片抵现有技术两片”的效果。
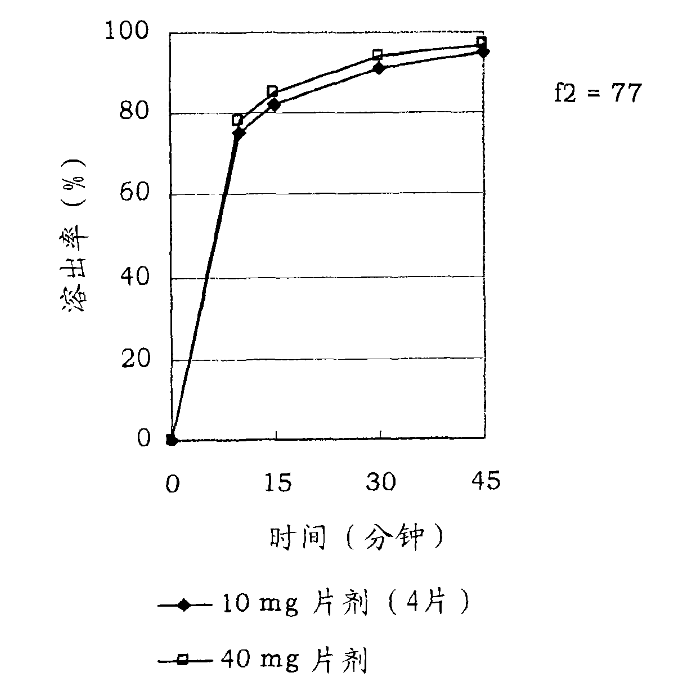
附图1
该专利说明书通过系列试验对发明涉及的不同方案的效果进行验证,并采用相似性因子f2作为评价溶出特性相似性的指标,即f2值在50≤f2≤100,则可说明不同的制剂之间具有相似的溶出特性。但需要强调的是,f2系被检测的药物组合物与作为参照的药物组合物(简称参照物)中活性成分的溶出特性进行比较后所得的比值。因此,相同被检测药物在与相对不同溶出特性的参照物进行比较时,所得的f2值会存在不同。例如,若用于计算f2值的被检测药物与参照物的溶出率均较低的情况下(假设均只有现有技术的一半),此时虽可得到f2的值为50≤f2≤100,但由于被检测药物的溶出率较低,必然达不到“该专利一片抵现有技术两片”的效果,此种情况显然不能实现该专利的发明目的。由此可见,在对比实施例中,单纯考察f2的值并不足以说明该专利是否实现了发明目的;只有当作为参照物的药物组合物,其在相同时间点的溶出率与现有技术“活性成分含量较低的多药片”的溶出率相似的情况下,再考察f2的值才是有意义的。换言之,对于不同粒径lurasidone粉末制成的药剂而言,其均要达到与现有技术相似的溶出率(即附图1所显示的情形)的前提下,此时f2的值若满足50≤f2≤100,方可说明该专利能够实现其发明目的。
通过该专利说明书的记载可知,影响lurasidone口服制剂的溶出特性的因素有多种,如组合物的组份、lurasidone的含量、以及lurasidone粉末的粒径等。
尤其是说明书第[0082]段记载
“据发现,通过使用lurasidone散装粉末制备的制剂显示相似的溶出特性,其中所述散装粉末的50%粒径在1至8μm,90%粒径的粒度分布为27μm或更小。”
更进一步的,在说明书实施例15中,当其采用50%粒径为13.9μm,90%粒径的粒度分布为58.3μm时并以实施例4作为参照时,f2的值不满足50≤f2≤100。通过说明书的以上记载,可以获知lurasidone粉末的粒径对于其溶出特性存在影响,从而将直接影响该专利的发明目的实现与否,故本领域技术人员不能预期对lurasidone的粒径分布不进行限定的方案也可以实现该专利的发明目的。然而,该专利权利要求1-16、18-19中,并未对lurasidone的粒径进行限定,故此,被诉决定认定上述权利要求得不到说明书的支持,并无不当。
对于权利要求17,其虽限定了lurasidone平均粒径为0.1-8μm,但该专利说明书中“所述散装粉末的50%粒径在1至8μm,90%粒径的粒度分布为27μm或更小”的表述意味着D50%和D90%的表述应为同时满足的关系,需要两者均符合要求方可实现所述溶出相似性的效果。因此,本领域技术人员不能预期仅用该平均粒径(即D50%)进行限定的所有粒度分布情况均可以实现发明目的,故权利要求17亦得不到说明书的支持。
庭审中,原告主张,该专利背景技术对lurasidone来讲是有在先配方存在的,该专利不解决不同粒径lurasidone的溶出相似问题,对于lurasidone的口服制剂,其粒径是隐含限定的。对此,北京知识产权法院认为,作为本领域的公知常识,《药剂学》及《中华人民共和国药典》记载了制备片剂的药物一般要求粉末细度在80-100目以上,80-100目对应的筛孔内径为180-150μm。而实施例15中所采用的粒径(D10%为1.5μm,D50%为13.9μm,D90%为58.3μm)并未超出本领域技术人员通常选择的范围。同时,原告虽主张该专利对于lurasidone口服制剂的粒径是隐含限定的,但是说明书第[0015]段记载“优选将该化合物细细研磨,例如90%体积或更多的粒子具有27μm或小粒径”,此处使用“优选”一词,表明说明书中亦未对lurasidone的粒径范围进行限制,结合说明的上述记载,此可进一步证明该专利权利要求中对于粒径未予限定,并非意味着lurasidone的口服制剂的粒径系隐含限定,而是相应权利要求的保护范围涵盖了不同范围粒径的lurasidone粉末。再者,从该专利权利要求之间的限定逻辑来看,权利要求17作为权利要求1-6的从属权利要求,其进一步限定了lurasidone平均粒径,由此进一步说明,权利要求1-6未限定lurasidone的粒径,并不存在隐含限定的情况。故此,原告的上述主张均不能成立。
此外,原告虽在诉讼中提交新的证据材料,但此并非被诉决定作出的依据,同时,上述证据中也均未考察不同粒径范围的lurasidone粉末的组合制剂是否达到了与现有技术相似的溶出特性,故其不足以影响本案结论。
综上所述,该专利权利要求1-19均不符合专利法第二十六条第四款的规定,被诉决定程序合法,结论正确。原告的诉讼请求缺乏事实与法律依据,不应予以支持。

![]() 法官提示
法官提示
本案系涉及专利法第二十六条第四款的规定,根据该款规定,如果权利要求的概括包含申请人推测的内容,而其效果又难于预先确定和评价,则应当认为这种概括超出了说明书公开的范围,得不到说明书的支持。如果权利要求的概括使所属技术领域的技术人员有理由怀疑该上位概括所包含的一种或多种下位概念或选择方式不能解决发明的技术问题,并达到相同的技术效果,则应当认为该权利要求没有得到说明书的支持。
因此,对于“权利要求得不到说明书的支持”,主要考虑的是权利要求限定的保护范围,是否均能解决相应的技术问题,或者说,能否实现发明的技术效果。通俗的讲,就是权利要求是不是限定范围过大的问题。在具体案件审理的过程中,主要考虑的是说明书中所列的实验数据是否存在“坏点”,所谓“坏点”,即在实验数据中,出现了明显不能达到说明书所宣称的技术效果的数据。一旦出现实验数据的“坏点”,而相应权利人又不能合理解释的,则一般会认定“权利要求得不到说明书的支持”。
本案中,对于该专利要解决的技术问题是现有技术中,较大粒径的lurasidone粉末溶出率低的问题,其要达到的技术效果为对于较大粒径lurasidone粉末制成的药剂而言,其均要达到与现有技术相似的溶出率。上述技术效果,具体可以通过考察f2的值进行判定,若满足50≤f2≤100,即可说明该专利能够实现其目的。但在说明书实施例15中,当其采用50%粒径为13.9μm,90%粒径的粒度分布为58.3μm时并以实施例4作为参照时,f2的值并不满足50≤f2≤100。即说明书的实施例中,实验数据存在“坏点”,即本领域技术人员不能预期对lurasidone的粒径分布不进行限定的方案也可以实现该专利的发明目的。
当然,并非实验数据中存在“坏点”,就一定会导致“权利要求得不到说明书的支持”,如果权利人能够进行合理的解释,则可以排除“坏点”的影响。本案中,原告主张对于lurasidone的口服制剂,其粒径是隐含限定的。但是,根据本领域的公知常识,实施例15中所采用的粒径并未超出本领域技术人员通常选择的范围。同时,原告虽主张该专利对于lurasidone口服制剂的粒径是隐含限定的,但是说明书记载“优选将该化合物细细研磨,例如90%体积或更多的粒子具有27μm或小粒径”,此处使用“优选”一词,表明说明书中亦未对lurasidone的粒径范围进行限制,结合说明的上述记载,此可进一步证明该专利权利要求中对于粒径未予限定,并非意味着lurasidone的口服制剂的粒径系隐含限定,而是相应权利要求的保护范围涵盖了不同范围粒径的lurasidone粉末。
综上可知,该专利权利要求的保护范围中,包含申请人推测的内容,而其效果又难于预先确定和评价,故其超出了说明书公开的范围,得不到说明书的支持。
(原标题:“一片顶过去两片”?你的专利权利要求能得到说明书支持吗 | 以案释法)
来源:知产北京
作者:王东
编辑:IPRdaily辛夷 校对:IPRdaily纵横君
注:原文链接:“一片顶过去两片”?你的专利权利要求能得到说明书支持吗(点击标题查看原文)

「关于IPRdaily」
IPRdaily是全球领先的知识产权综合信息服务提供商,致力于连接全球知识产权与科技创新人才。汇聚了来自于中国、美国、欧洲、俄罗斯、以色列、澳大利亚、新加坡、日本、韩国等15个国家和地区的高科技公司及成长型科技企业的管理者及科技研发或知识产权负责人,还有来自政府、律师及代理事务所、研发或服务机构的全球近100万用户(国内70余万+海外近30万),2019年全年全网页面浏览量已经突破过亿次传播。
(英文官网:iprdaily.com 中文官网:iprdaily.cn)
本文来自知产北京并经IPRdaily.cn中文网编辑。转载此文章须经权利人同意,并附上出处与作者信息。文章不代表IPRdaily.cn立场,如若转载,请注明出处:“http://www.iprdaily.cn

 共发表文章4677篇
共发表文章4677篇文章不错,犒劳下辛苦的作者吧
- 我也说两句
- 还可以输入140个字












