没收到验证邮件?请确认邮箱是否正确或 重新发送邮件

#本文仅代表作者观点,不代表IPRdaily立场,未经作者许可,禁止转载#
来源:IPRdaily中文网(iprdaily.cn)
作者:贺伊博 北京允天律师事务所 平大为 绿叶制药集团
原标题:浅谈药品专利期限补偿制度中化学药品的范围
近期,国家知识产权局就《专利法实施细则修改建议(征求意见稿)》向社会公众公开征求意见。意见稿中就药品专利期限补偿制度进行了详细的规定。本文希望基于我国国情,结合美国、日本、欧洲、韩国、以色列等主要国家和地区的药品专利期限补偿制度针对化学药品范围的相关规定做一总结和比较,为我国药品专利期限补偿制度的具体实践中如何定义化学药品范围提供参考。
[关键词] 化学药品;专利保护期;药品专利期限补偿;比较研究
2020年11月27日,国家知识产权局就《专利法实施细则修改建议(征求意见稿)》(下称意见稿)向社会公众公开征求意见[1]。意见稿第八十五条第四款规定“对在中国获得上市许可的化学药、生物制品和中药新药产品专利、制备方法专利或者医药用途相关专利,符合药品专利期限补偿条件的,可以给予药品专利期限补偿。前款所称新药相关专利,是指国务院药品监督管理部门首次批准上市的新药活性成分相关专利。中药新药专利包括中药创新药相关专利和增加功能主治的中药改良型新药相关专利。”
以化学药为例,根据《化学药品注册分类及申报资料要求》(下称注册分类)的规定[2],我国化学药品注册分类分为创新药、改良型新药、仿制药、境外已上市境内未上市化学药品。其中创新药指含有新的结构明确的、具有药理作用的化合物,且具有临床价值的药品,其毫无疑义属于新药活性成分。而改良型新药指在已知活性成份的基础上,对其结构、剂型、处方工艺、给药途径、适应症等进行优化,且具有明显临床优势的药品,其是否属于新药活性成分尚无定论。本文希望基于我国国情,结合美国、日本、欧洲、韩国、以色列等主要国家和地区的药品专利期限补偿制度针对化学药品范围的相关规定做一总结和比较,为我国药品专利期限补偿制度的具体实践中如何定义化学药品范围提供参考。
一、主要国家和地区药品专利期补偿制度的相关规定
(一)美国
美国于1984年颁布了Hatch-Waxman法案,作为平衡创新药厂(Brand Name Drug)、仿制药厂和社会公众利益之间利益关系的制度,也在美国医药产业乃至世界医药产业发展历程中具有里程碑意义。该法案主要规定了五个方面的内容: (1)仿制药简化申请程序,(2)专利链接制度,(3)专利保护期补偿制度(Patent Term Extension),(4)Bolar 例外制度,(5)药品市场独占期制度。Hatch-Waxman法案后,美国政府陆续颁布了《仿制药实施法案》(Generic Drug Enforcement Act,GDEA)和《更容易获得可支付药品法案》(Greater Access to Affordable Pharmaceutical Act,GAAPA)等五部法案,从而对Hatch-Waxman 法案的缺陷进行弥补和完善。经过多年的演变,如今形成了美国专利法35 U.S.C. 156条规定的保护期限延长制度。
35 U.S.C. 156条(f)规定,药品一词是指以下药物的活性成分:(1)药品,包括:(A)新药、抗生素药或人类生物制品(如《联邦食品,药物和化妆品法》和《公共卫生服务法》中所用的术语)(药品包括任何活性成分的盐或酯,作为单一实体或与另一种活性成分组合使用),(B)不是主要使用重组DNA,重组RNA,杂交瘤技术生产的新的动物药或兽用生物产品(如《联邦食品,药物和化妆品法》和《病毒-血清毒素法》所用)或其他涉及特定地点的基因操作技术的过程;或 (2)受《联邦食品,药品和化妆品法案》管制的任何医疗器械,食品添加剂或色素添加剂[3]。
如果在先游离酸/碱形式的活性成分已获批上市,后续该活性成分的药用盐/酯是否能落入化学药品的范围,美国专利商标局(USPTO)和法院之间往往持有不同的观点。1990年的Glaxo Operations Uk Ltd. v. Quigg案中,已有获批药品的活性成分为头孢呋辛游离酸,新获批的药品活性成分为头孢呋辛酯,法院判决认为由于头孢呋辛酯从未被批准作为药物的“活性成分”,并批准延长头孢呋辛酯的专利保护期。同样地,2010年的Photocure v. Kappos案,USPTO驳回了Photocure公司提出的Metvixia®活性成分氨基乙酰丙酸甲酯盐酸盐(MAL盐酸盐)相关专利US6,034,267的PTE请求。USPTO的理由是:氨基乙酰丙酸甲酯盐酸盐是之前已获批活性成分氨基乙酰丙酸盐酸盐(ALA盐酸盐)的酯,而氨基乙酰丙酸甲酯盐酸盐的潜在活性分子是氨基乙酰丙酸盐酸盐。由于含有ALA盐酸盐的药品先前已获得FDA的批准,因此不满足35 U.S.C. 156(a)(5)(A)的规定。但是,联邦巡回上诉法院认为:Metvixia®(即MAL盐酸盐)用于光化学疗法或光动力疗法中,以治疗光化性角化病,这种光化性角化病是皮肤上癌变前的生长。MAL盐酸盐是一种新型化合物,其与已知的化合物ALA盐酸盐相比具有更高的治疗性能,因此US6,034,267专利获得了授权。而且US6,034,267专利说明书讨论并举例说明了MAL盐酸盐产品相对于ALA盐酸盐产品的生物学和生理优势。MAL盐酸盐产品的可专利性没有争议。另外,该产品需要FDA的完全批准,其临床和其他实验证明了MAL盐酸盐的安全性和有效性,历时四年半。测试完成后,Photocure向PTO申请延长了267专利的期限。因此,根据21 U.S.C. § 321(p)的规定,MAL盐酸盐被视为“新药(新的活性成分)”,因其未被获批作为药物的“活性成分”,据此批准延长其专利保护期。
但是,如果活性成分的可药用盐/前药(例如:酯化物)已获批上市,后续该活性成分的游离酸/碱获批上市时将无法获得专利保护期限补偿(PTE)。2017年3月,USPTO拒绝了BUTRANS®链接专利RE 41,571的PTE请求。理由是:FDA已批准上市的三款药物BUPRENEX®(NDA No. 018401)、SUBUTEX® (NDA No. 020732)和SUBOXONE®(NDA No. 020733)中,其活性成分/活性成分之一为丁丙诺啡盐酸盐,BUTRANS®的活性成分丁丙诺啡的游离碱。根据35 U.S.C. 156条(f)和35 U.S.C. 156(a)(5)(A)的规定:(1)药品包括任何活性成分的盐或酯,作为单一实体或与另一种活性成分组合使用;(2)批准的产品商业营销或使用的上市许可是法律规定的首次批准的产品商业营销或使用的上市许可。也就是说,丁丙诺啡游离碱已经不属于首次批准的药品/活性成分(包括活性成分的盐或酯)的商业营销或使用的上市许可,因而其专利没有获得PTE延长的资格[4]。
另外,关于药物联用/复方的药品是否可以获得PTE的延长。在The Arnold Partnership v. Dudas案中,联邦巡回法院认为:35 U.S.C. 156条 (f) 规定 “药品一词包括任何活性成分的盐或酯,作为单一实体或与另一种活性成分组合使用” ,也就是说,该法条所指的药品是以 “每个/逐个组分(component-by-component)”作为判断基础,而非药物组合的整体。所以,对于一个包含两种或两种以上活性成分的药物/产品,其中至少一个活性成分是首次批准的上市许可,即可作为获得PTE延长的基础;其它组分/活性成分仅仅是与首次批准上市许可的活性成分的“组合”[5]。
综上所述,美国对于专利保护期延长PTE的判断基础是任一活性成分(包括可药用盐、酯等形式),对于单一活性成分的药物产品,如果其活性成分是首次获得上市批准,如:新分子实体(New Molecular Entity),则可以获得专利保护期限延长。同时,如果首次获得上市批准是化合物A,后续开发化合物A的酯或可药用盐作为活性成分的产品,则首次获得上市批准的酯化物或可药用盐同样可以作为专利保护期延长的基础。此外,对于含有两种或两种以上的药物产品,如果其中至少一个活性成分(包括可药用盐、酯化物)是首次批准的上市许可,即可作为获得PTE延长的基础。
另一方面,如果首次获得上市批准是化合物A的酯化物或可药用盐,后续开发化合物A作为活性成分的产品,根据35 U.S.C. 156条(f)的规定,化合物A的酯化物或可药用盐曾作为首次获得上市批准的基础,该化合物A将不再属于首次获得上市批准的活性成分,故无法再次获得专利保护期延长。或者是,如果某个或多个活性成分曾获得上市许可,根据35 U.S.C. 156(a)(5)(A)的规定,相同药品/活性成分的新医药用途、相同药品/活性成分的新给药方案、相同药品/活性成分的新配方或新剂型、相同药品/活性成分的组合/联合用药等主题不得作为获得专利保护期延长的基础,即并非所有的NDA上市许可均有资格使专利保护期限延长。
(二)欧盟
1992年6月18日,欧盟颁布的理事会条例(EEC)第1768/92号,其中涉及用于药用产品的补充保护证书(Supplementary Protection Certificate,SPC),此条例于1993年1月2日生效。之后,欧洲议会和理事会于2009年5月6日颁布的(EC)第469/2009号条例,关于药品的补充保护证书,并于2009年7月6日在整个欧盟生效。(EC)第469/2009号条例第1条规定:(a)“药品(medicinal product)”是指为治疗或预防人类或动物疾病而提出的任何物质或物质组合,以及为进行医学诊断或恢复而可能施用于人类或动物的任何物质或物质组合,纠正或改变人类或动物的生理功能;(b)“产品(product)”是指药品的有效成分或有效成分的组合;(c)“基本专利(basic patent)”是指保护产品本身,获得产品的方法或产品的用途,并由其持有人为授予证书的程序而指定的专利;(d)“证书”是指补充保护证书;(e)“延长期限的申请”是指根据本法规第13条第3款和欧洲议会1901/2006号法规(EC)第36条的规定,延长证书期限的申请。2006年12月12日理事会,关于儿科用药品(5)。(EC)第469/2009号条例第3条规定:如果在提交第7条所指的申请的成员国中并且在该申请的日期:(a)产品受到保护的基本专利是有效的;(b)根据适用的第2001/83 / EC号指令或第2001/82 / EC号指令,药品已获得其投放市场的上市许可证;(c)该产品尚未申请过保护期延长;(d)(b)所指的上市许可是产品作为药品投放市场的首次上市许可[6]。由此可见,欧洲关于专利保护期延长的条件为:(1)保护药品的基础专利(包括活性成分专利、制备方法专利、用途专利)处于有效期;(2)药品获得了首次上市许可证;(3)该产品没有被授予过专利保护期延长。除了上述条例的规定,CJUE(Court of Justice of the European Union,欧洲联盟法院)还通过一系列的判例明确了化学药品范围。
C-443/17 (Abraxis Bioscience LLC v Comptroller General of Patents) 案中,CJUE认为,SPC法规第3(d)条与第1(b)条结合阅读时,必须解释为,当活性成分已经在之前被授予上市许可的情况下,不能将已知活性成分的新配方/制剂的上市许可视为该产品的首次上市许可。
C-673/18 (Santen SAS)案中,CJUE认为,欧洲议会和理事会关于医药产品补充保护证书的(EC)第469/2009号条例第3条(d)款必须解释为:如果上市许可涉及活性成分或活性成分组合的新治疗应用,且该活性成分或组合已经获得过治疗不同疾病的上市许可,则该上市许可不能被视为首次上市许可。
C-443/12 (Actavis Group v Sanofi)案中,1999年2月8日Sanofi公司基于伊贝沙坦药品(单一活性成分)的上市许可获批补充保护证书(SPC);1999年12月21日,该公司的伊贝沙坦与氢氯噻嗪作为利尿剂的药物组合也获批补充保护证书(SPC)。CJUE认为,欧洲议会和理事会关于药品补充保护证书第469/2009号条例(EC)第3(c)条的必须解释为:不允许专利持有人在同一专利的基础上,为之后获得的含有该活性成分和另一种不受专利保护的活性成分的不同医药产品的上市许可,而获得与该活性成分组合物有关的第二份补充保护证书。
由此可见,对于已知活性成分的新制剂、适应症,已知活性成分与未被专利保护的其它活性的药物组合均不能再次获得欧洲补充保护证书。
(三)日本
日本专利法第67之3第1款规定了专利权的延长期限的登记申请属于下列任何一项的,审查员应当决定驳回该请:(1)当所获得的第67条之2政令所规定的药品上市许可证对于专利所保护的发明不具有必要性;没有意识到有必要接受时;(2)专利权人、拥有专利权排他性许可的被许可人、或者非排他性许可的被许可人没有获得第67条之2的规定的政府条例规定的药品上市许可证;(3)请求保护期延长的期限超过了发明专利无法实施的期限;(4)提交保护期延长申请的人不是专利权人;(5)当申请不符合第67条之2条第(4)款的要求时(注:第67条之2条第(4)款:如果根据第(1)款提交文件的人由于不可抗力的原因而无法在该款规定的期限内提交申请文件,则该申请人可以在不可抗力因素不存在之日起14天内提交申请文件(如果该申请人来自海外,则自该理由不存在之日起一个月内),但不得迟于该款规定的日期之后的两个月)。
同时,日本专利审查指南第九部分第一章3.1节关于“专利保护期限延长申请书的审查要求判断”规定了:审查员审查药品等的专利保护期延长申请时,应判断专利法第67条之3第1款的规定是否适用。如果属于其中的任何一项,则属于拒绝/驳回保护期延长的理由。
由于日本专利法第67之3第1款的规定中没有明确记载驳回理由包括“药品的上市许可为首次上市许可”,所以从专利法立法来看,日本并没有规定“非首次上市许可”不可以申请专利保护期延长的条件。
另一方面,日本专利审查指南第九部分第二章3.1节是关于药品等专利保护期限延长申请的审查要求判断。其中,3.1.1节(3)具体规定了:对于一项专利权存在多个相对应的批准药品上市许可证时,如果每一项上市许可证均被认为是为实施专利发明所获得的药品上市许可的情况下,可以基于多个不同的药品上市许可分别提出保护期限申请,从而延长同一专利权的期限。
下面以盐酸多奈哌齐的相关日本专利保护期为例:多奈哌齐化合物专利为特许JP2578475B2,该专利分别基于第1-5次所获得的药品上市许可(获批处分1-5)分别获得了不同的专利保护期限延长。同时,盐酸多奈哌齐制剂专利特许JP3770518B2,该专利也基于第4次所获得的药品上市许可(获批处分4)。盐酸多奈哌齐的各项上市许可信息参见表1。
表1 盐酸多奈哌齐日本上市许可信息
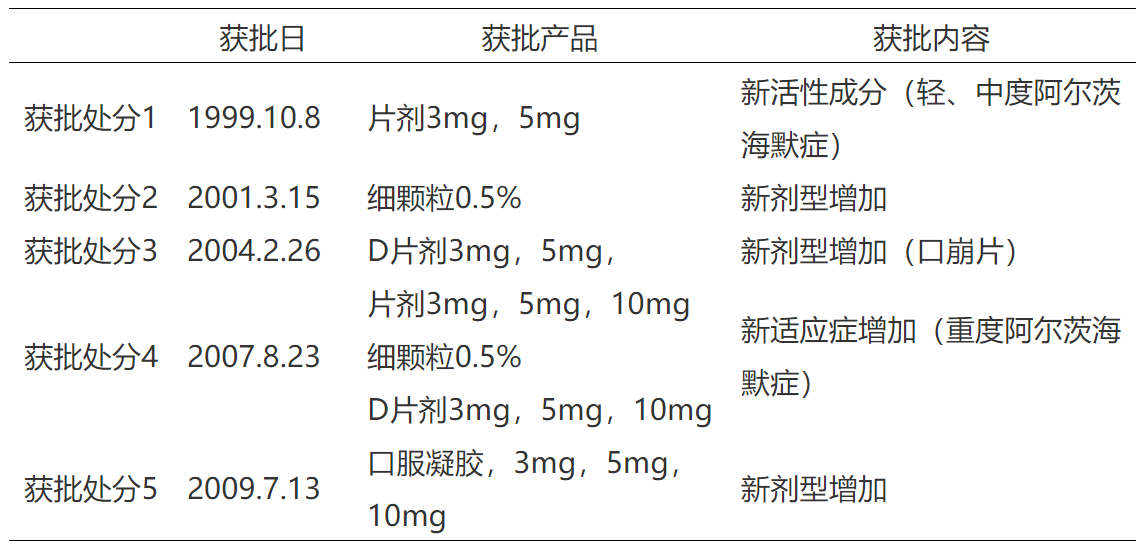
实践中,盐酸多奈哌齐相关专利保护期限延长参见图1[7]:
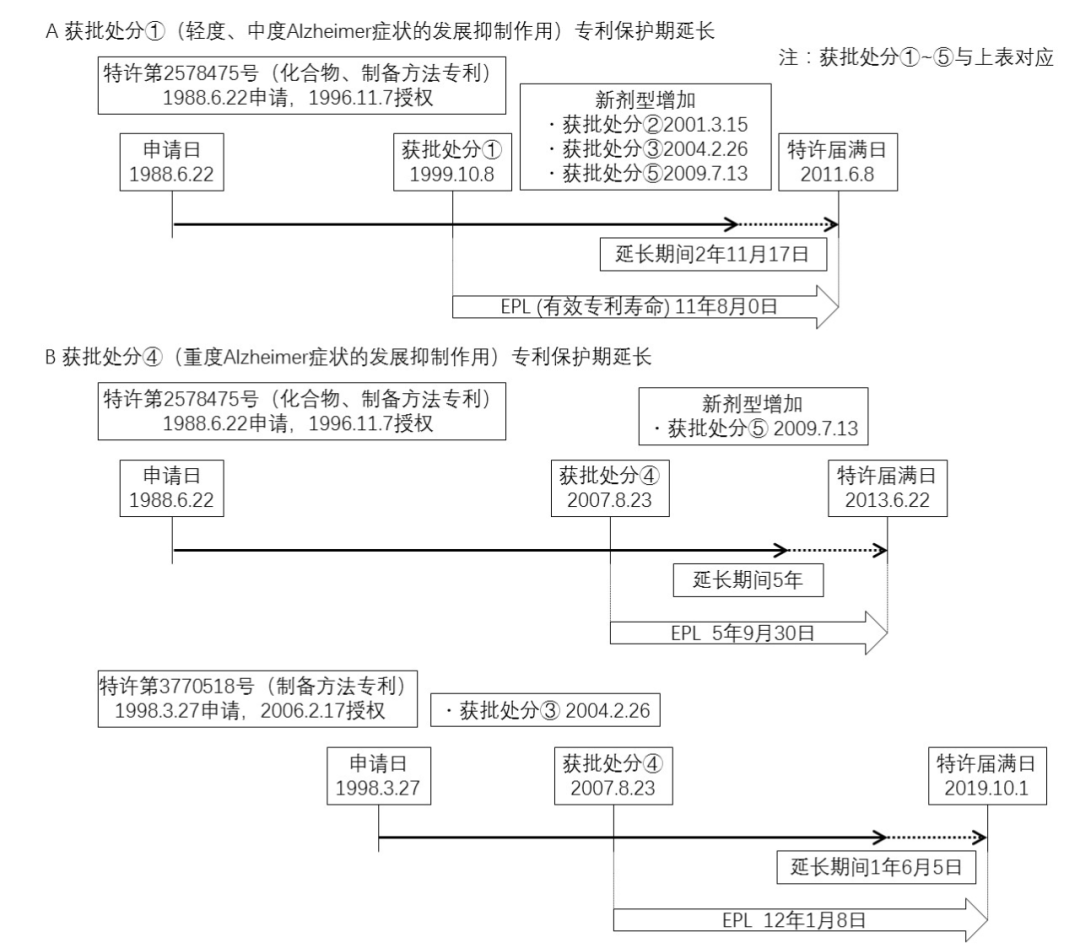
图1 盐酸多奈哌齐日本相关专利保护期限延长分析
由此可见,日本专利法及其相关规定并未规定仅“首次上市许可”才可以获得专利保护期延长。而且,基于现有药物的专利保护期限延长实例,可以确定改良型制剂、新适应症等其它的后续上市许可也可以作为专利保护期限延长的基础,并多次延长专利的保护期限。
(四)韩国
韩国现行的《特许法实施令》规定保护期限延长对象为以“新物质”为有效成分制作的“最初”得到许可的药物。其中“新物质”是指起到药效的活性成分的化学结构是新的物质[8]。在2013年改法前,保护期限延长对象除了上述新物质外还包括已知有效成分的复合药物。虽然改法后已明文规定了保护期限延长对象仅限于新物质,但是关于如何定义新物质的范围有多个行政诉讼在进行中。
在韩国专利法院作出的2015HE1256号判决中[9],针对包含12种已知草药的组合物是否能够享受专利保护期延长,法院认为是否许可专利法第89条第1款规定的保护期延长,其依据的是申请获得许可的对象是否因为为获得《药事法》的许可而针对稳定性等测试花费了很长时间,专利法的该条款并未区分该对象是否为新药(新物质)。此外,对于不同种类的药物,即使是新药,也可能存在由于全部或部分国内临床试验均获豁免而导致其获得《药事法》许可所需的测试可能不会花费很长时间的情况。因此,需要具体的情况,判断申请许可的对象是否因为获得许可所需的活动和安全性等测试导致花费了很长时间,所有花费很长时间进行活性测试和安全性测试的药物所涉及的专利保护期限都可以被延长。由此可见,在没有审查/考量所批准药物所需的活性/安全性测试是否花费很长时间的情况下,仅因为它不是一种新药(一种新物质)而拒绝保护期限延长是违法的。
在韩国专利法院作出的2016HE9035号判决中[10],针对阿利维A酸凝胶剂是否能够享受专利保护期延长,法院认为阿利维A酸即9-顺式维甲酸虽然是先前已获准用于该产品的药物的活性成分维甲酸的几何异构体。一般来说,几何异构体的三维结构不同,不同异构体的物理化学性质如电离或生物活性方面均存在显着差异。此外,与维甲酸仅结合视黄酸受体(RAR)不同,阿利维A酸还与类视黄醇X受体(RXR)结合,导致阿利维A酸具有维甲酸所不具有的治疗慢性手湿疹的作用。由此可见,鉴于几何异构体的一般性质以及每种活性成分的作用和效果的差异,阿利维A酸凝胶剂对慢性手湿疹的治疗效果与先前批准的药物不同,阿利维A酸作为有效成分是新的,并且是第一个获得项目许可的药品。
2018年10月,韩国大法院在2014DU37702号裁决中认为[11],在解释保护期限延长对象的含义时,应合理考虑修订后的立法目的,宗旨和内容。为了改善公众的健康和卫生状况并确保安全性和有效性,专利权人需要根据《药事法》等法律法规获得许可后方能实施药品等发明专利。由此导致专利权人不能在获得许可的过程中实施发明专利,否则将受到处罚。因此,为了减轻上述不利条件并保护和鼓励药物等,韩国建立了一套专利权保护期限延长的制度。考虑到这种制度的目的,如果需要很长时间来测试许可或注册所需的活性和安全性,则可以延长专利权的期限,不排除专利权延长的范围。
由此可见,如果有效成分为化合物时,新物质的范围是否包括其盐、酯、异构体、溶剂化物和结晶型等不同形态目前没有统一的判断标准,但是根据韩国大法院的最新判决,如果新物质为异构体等形态时也有可能获得保护期限延长。
(五)以色列
以色列目前施行的专利法于1967年8月8日由内阁会议通过,并于1968年4月1日实行。近年来,以色列分别于1995年和1998年对专利法进行了两次修改。在1998年的修法中,加入了药品专利期补偿制度的相关规定。按照现行专利法的规定,其可申请专利期补偿的专利包括保护任何材料的生产工艺、材料的使用、包含材料的药物制剂以及生产包含材料或医疗设备的药物制剂的过程等的专利。其中药物制剂是指经过加工的任何形式的治疗药物,包括用于兽医的制剂和拟通过静脉注射的营养价值制剂;材料是指药物制剂的活性成分或该成分的盐、酯、水合物或晶体形式[12]。由此可见,如果活性成分为化合物时,其范围不仅包括盐、酯、水合物或晶体形式,还进一步包括药物制剂。
二、对我国的启示
新药研发具有高投入、高风险、长周期等特点,虽然截止2019年,FDA在近十年共批准了289个新分子实体,较2000-2009年的194个有很大的增长[13],但是随着潜在新的化合物结构发现数量的快速增多以及合成难度的提高,普遍认为,当前化学药品的创新似乎已经走入瓶颈,化学新药研发的难度越来越大。
具体到我国,2018-2020年,NMPA批准上市的新药情况如下:

虽然近三年国产新药获批的数量呈逐年递增的趋势,但不可否认的是进口新药在我国仍然是主力,国产新药短期内还无法撼动进口新药的优势地位。同时,国内药企在创新药研发过程中、特别是化学新药创制中存在自主创新药物少;在研靶点也以追随为主,缺乏原创理论等问题。与发达国家或国相比,我国医药产业整体水平相对滞后,研发投入不足,企业竞争力仍然处于劣势。按照判断一个国家创新贡献的2个指标(上市研发前的产品数量占全世界的比例、上市后的新药数占全世界的比例),我国处在美国、日本、英国和德国等之后的第三梯队[17]。改良型新制剂的研发是介于创新药物研究和仿制药开发之间的受到全球药剂从业者重视的新药开发途径。虽然在该领域,我国鲜有重大的技术突破和重磅产品问世,但是我国的基础研究非常出色,尤其在纳米技术、靶向技术以及SCI论文发表等方面。值得一提的有获得巨大成功的注射用紫杉醇脂质体(力扑素),还有中国首创的激光打孔渗透泵控释片非洛地平缓释片(Ⅱ)[18]。
为了鼓励创新,2017年10月8日,中共中央办公厅和国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,在第三点促进药品创新和仿制药发展中包括开展药品专利期限补偿制度试点。选择部分新药开展试点,对因临床试验和审评审批延误上市的时间,给予适当专利期限补偿[19]。2018年4月12日国务院常务会议决定,为减轻广大患者特别是癌症患者药费负担并有更多用药选择,对在中国与境外同步申请上市的创新药给予最长5年的专利保护期限补偿[20]。
根据目前我国针对改良型新药的注册要求,改良型新药在申请上市审批前一般需要开展药物临床试验以证明其具备明确的临床优势[21]。如某抗肿瘤化药的改良型新药,通过剂型优化,其客观缓解率(objective response rate, ORR)显著提高并转化为生存获益,认为是明确的疗效优势;或者改良后药品用于境内已上市药品未获批的适应症,与该适应症的标准治疗相比,具有明显的临床获益,如果该适应症尚无标准治疗,通过安慰剂对照等试验确证化药改良新药的临床获益也是明确的疗效优势。这样的临床试验同样也需耗费申请人大量的时间,如果药品专利期限延长排除了改良型新药显然不利于鼓励创新主体积极性。
鼓励创新,兼顾国情,笔者认为我国不宜采取似欧盟那样严格的新药标准,建议将在上市审批前开展了药物临床试验以证明其具备明确的临床优势的改良型新药也纳入新药范围,这样既能促进国外原研新药尽早进入我国市场,有利于满足我国的用药需求,也能促进国内药企提高创新水平。
[参考文献]
[1] “关于就《专利法实施细则修改建议(征求意见稿)》公开征求意见的通知”, [EB/OL] (2020-11-27). [2021-04-01]. https://www.cnipa.gov.cn/art/2020/11/27/art_75_155294.html.
[2] “国家药监局关于发布化学药品注册分类及申报资料要求的通告(2020年第44号)”,[EB/OL] (2020-06-30) [2020-10-01]. https://www.nmpa.gov.cn/yaopin/ypggtg/ypqtgg/20200630180301525.html.
[3] 《专利审查程序手册(MPEP)》,[EB/OL] (2019-10-31) [2021-04-01].
https://www.uspto.gov/web/offices/pac/mpep/.
[4] Notice of Final Determination-Ineligible of RE 41,571; [EB/OL] (2011-10-31) [2021-04-01]. https://www.fdalawblog.net/2011/10/pto-says-pte-not-available-in-reverse-photocure-case-1/.
[5] ARNOLD PARTNERSHIP v. DUDAS [EB/OL] (2004-12-31) [2021-04-01]. https://www.leagle.com/decision/20041700362f3d133811540.
[6] REGULATION (EC) No 469/2009 OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL [EB/OL] (2009-06-16) [2021-04-01]. https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=CELEX%3A32009R0469.
[7] 佐野 哲,特許権の存続期間の延長制度が新薬の研究開発投資に与える影響について [J],日本知財学会誌,2012, 9(2):69-88.
[8] 《特许法实施令》(第24491号总统法令),[EB/OL] (2013-04-03) [2021-04-01].
https://www.law.go.kr/LSW/lsInfoP.do?lsiSeq=138425&chrClsCd=010203&urlMode=engLsInfoR&viewCls=engLsInfoR#0000.
[9] 韩国专利法院第2015HE1256号判决,[EB/OL] (2016-01-29) [2021-04-01].
https://www.law.go.kr/LSW/spancInfoP.do?mode=0&spancSeq=180298.
[10] 韩国专利法院第2016HE9035号判决,[EB/OL] (2017-12-21) [2021-04-01].
https://www.law.go.kr/LSW/spancInfoP.do?mode=0&spancSeq=193075.
[11] 韩国大法院第2014DU37702号裁决,[EB/OL] (2018-10-04) [2021-04-01].
https://www.law.go.kr/LSW/spancInfoP.do?mode=0&spancSeq=203775.
[12] 《以色列专利法》(2014年版),[EB/OL] (2014-12-31) [2021-04-01].
https://wipolex.wipo.int/zh/text/341499.
[13] “New Drugs at FDA: CDER’s New Molecular Entities and New Therapeutic Biological Products”, [EB/OL] (2021-02-05) [2021-04-01]. https://www.fda.gov/drugs/development-approval-process-drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products.
[14] 盘点·2018年NMPA批准上市的51款新药, [EB/OL] (2018-12-29) [2021-04-01].
https://med.sina.com/article_detail_100_2_58333.html.
[15] 盘点·2019年NMPA批准的53个新药, [EB/OL] (2020-01-02) [2021-04-01].
https://xueqiu.com/8965749698/138522510.
[16] 2020年NMPA批准新药48款, [EB/OL] (2021-01-01) [2021-04-01].
https://www.sohu.com/a/441856645_120051826.
[17] 敖翼等,我国新药创制的发展现状及问题浅析 [J],《中国新药杂志》,2020,29(1):33-41.
[18] 王浩,改良型制剂:不平坦的创新之路 [J],《药学进展》,2018, 42(12):881-883.
[19] “中共中央办公厅 国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》”,[EB/OL] (2017-10-08) [2021-04-01]. http://www.gov.cn/xinwen/2017-10/08/content_5230105.htm.
[20] “国务院常务会议”(2018年4月12日),[EB/OL] (2018-04-12) [2021-04-01].
http://www.gov.cn/guowuyuan/gwycwhy/20180412c06/index.htm.
[21] “国家药监局药审中心关于发布《化学药品注册受理审查指南(试行)》的通告(2020年第10号)”,[EB/OL] (2020-07-03) [2021-04-01]. http://www.cde.org.cn/news.do?method=largeInfo&id=cf49ee232197abb1.
来源:IPRdaily中文网(iprdaily.cn)
作者:贺伊博 北京允天律师事务所 平大为 绿叶制药集团
编辑:IPRdaily王颖 校对:IPRdaily纵横君
注:原文链接:浅谈药品专利期限补偿制度中化学药品的范围(点击标题查看原文)
如有想看文章主题内容,欢迎留言评论~

「关于IPRdaily」
IPRdaily是具有全球影响力的知识产权媒体,致力于连接全球知识产权与科技创新人才。汇聚了来自于中国、美国、欧洲、俄罗斯、以色列、澳大利亚、新加坡、日本、韩国等15个国家和地区的高科技公司及成长型科技企业的管理者及科技研发或知识产权负责人,还有来自政府、律师及代理事务所、研发或服务机构的全球近100万用户(国内70余万+海外近30万),2019年全年全网页面浏览量已经突破过亿次传播。
(英文官网:iprdaily.com 中文官网:iprdaily.cn)
本文来自IPRdaily中文网(iprdaily.cn)并经IPRdaily.cn中文网编辑。转载此文章须经权利人同意,并附上出处与作者信息。文章不代表IPRdaily.cn立场,如若转载,请注明出处:“http://www.iprdaily.cn/

 共发表文章4399篇
共发表文章4399篇文章不错,犒劳下辛苦的作者吧
- 我也说两句
- 还可以输入140个字