没收到验证邮件?请确认邮箱是否正确或 重新发送邮件
点击图片,查看专题详情!
来源:IPRdaily中文网(iprdaily.cn)
作者:信建 华进国内专利事业部北京生物与化学部主管
原标题:医药用途专利的申请、保护及布局策略——从武汉病毒研究所申请的瑞德西韦(Remdesivir)治疗新冠肺炎的发明申请谈起
【导语】
瑞得西韦是一种在研的广谱抗病毒药物,尚未在任何国家获得用于临床的药物批注,其对公众而言本应非常陌生。但由于瑞得西韦是目前被寄予厚望的能够对新型冠状病毒肺炎进行治疗的候选药物之一,并且近期还被武汉病毒所“抢注”,引起轩然大波,成为最近的新闻热点之一。
医药用途在中国常以瑞士型权利要求进行撰写,瑞士型权利要求是化学领域的一种特殊类型的权利要求,其本身是一种“词不达意”的权利要求写法——既没能直截了当地阐述其创造性来源(已知药物在治疗新适应症中的用途),也与申请人真正意图得到的保护范围(保护药物或疾病诊断治疗方法)不符。虽然从形式上看瑞士型权利要求保护的主题是制药用途,但其实质在于保护已知药物在新适应症上的应用,这与权利要求的一般形式不符。由于这种特殊性,公众甚至很多知识产权领域的从业者也常常对其不甚清楚。在近几年(2014~2018年)国家知识产权局所公布的的“十大专利复审无效”案件中,以瑞士型权利要求作为主要撰写方式的案件几乎每一年都占有一席之地,特别是“胃肠基质肿瘤的治疗”和“用抗ErbB2抗体治疗”主要讨论的就是瑞士型权利要求的新颖性、创造性问题的审查,可见其一直是生物医药领域的热点和难点之一。
本文从瑞得西韦出发,对这种医药用途专利的申请给出较为全面的分析,透过瑞得西韦这个案例,可以更直观地提升公众对这类权利要求的理解与认识,并给予专利代理师和医药行业从业者对此类专利申请所要准备资料的要点及专利问题给予启示。同时,医药用途专利的申请过程中各方面的问题,但是围绕着瑞士型权利要求的保护和布局相关的问题,业界却一直颇有争论。本文就医药用途专利保护和布局跟各位看官一起聊聊。
中国科学院武汉病毒研究所(以下简称为“武汉病毒所”)在2020年02月04日发文“我国学者在抗2019新型冠状病毒药物筛选方面取得重要进展”引发公众广泛热议。
文章中提到:“瑞得西韦(Remdesivir,GS-5734)是核苷类似物,目前在刚果(金)开展治疗埃博拉出血热的Ⅱ和Ⅲ期临床研究。磷酸氯喹(Chloroquine)于上个世纪40年代起用于治疗疟疾,后用于治疗类风湿性关节炎等。上述两种药物在细胞水平上有效抑制2019新型冠状病毒感染的初步结果此前已通过多种形式向国家和省市相关部门报告。为服务于疫情防控,合作双方单位联合声明:在上述具有抗2019新型冠状病毒(2019-nCoV)作用的药物中,我们对于国内已经上市并能够完全实现自主供应的药物磷酸氯喹,不申请相关专利,以鼓励相关企业参与疫情防控的积极性;对在我国尚未上市,且具有知识产权壁垒的药物瑞得西韦,我们依据国际惯例,从保护国家利益的角度出发,在1月21日申报了中国发明专利(抗2019新型冠状病毒的用途),并将通过PCT途径进入全球主要国家。如果国外相关企业有意向为我国疫情防控做出贡献,我们双方一致同意在国家需要的情况下,暂不要求实施专利所主张的权利,希望和国外制药公司共同协作为疫情防控尽绵薄之力”。
现笔者从该案例出发,针对瑞士型权利要求如何申请和保护的相关专利问题做出讨论。当然,由于武汉病毒所披露的信息有限,故而这些讨论也比较局限,仅作为分析瑞士型权利要求专利特点的一个例子,并不用于真正预测或评价其技术方案的专利性。
1、何为瑞士型权利要求?其撰写注意事项有哪些?
从现有披露的内容中可以看出,武汉病毒所相对于现有技术所做的贡献是发现了已知药物瑞得西韦在抑制2019新型冠状病毒(世界卫生组织已将该病毒正式命名为“SARS-CoV-2”,其引发的2019冠状病毒病,即新型冠状病毒肺炎则被世界卫生组织正式命名为“COVID-19”)中的新医药用途。
我国专利法认为对于包含用途特征的产品权利要求,应当考虑权利要求中的用途特征是否隐含了要求保护的产品具有某种特定结构和/或组成。如果该用途由产品本身固有的特性决定,而且用途特征没有隐含产品在结构和/或组成上发生改变,则该用途特征限定的产品权利要求相对于对比文件的产品不具有新颖性。故而将武汉病毒所的技术内容撰写成:“用于抑制SARS-CoV-2或用于治疗COVID-19的药物,其主要活性成分包括瑞得西韦”,则由于适应症对瑞得西韦的结构和组成不会产生限定作用,该权利要求不具有新颖性。而若撰写成:“一种抑制人体内SARS-CoV-2(或治疗COVID-19)的方法,包括对患者给予有效量的瑞得西韦”,则其显然是一种疾病的治疗方法,又不符合专利法第25条的相关规定。
这就使得申请人陷入一种很尴尬的境地,如果申请人发现了一种已知药物的新用途,那么他既不能通过产品权利要求,也不能通过治疗方法权利要求对其创造性的发现进行保护,这明显与专利制度鼓励创新功能发挥、对于创新性成果的保护的宗旨背道而驰。为解决这种矛盾,一种新的权利要求类型应运而生,由于该形式的权利要求此前只在瑞士被接受,因此被称为瑞士型权利要求。瑞士型权利要求典型写法通常为“物质X在制备用于治疗Y病的药物中的应用”,其也通常被称为制药用途权利要求或第二医药用途权利要求。具体在本案例中,技术方案可以撰写为:瑞得西韦在制备用于抑制SARS-CoV-2的药物中的应用,或瑞得西韦在制备用于治疗COVID-19的药物中的应用(以下对包含这些权利要求的申请简称涉案申请)。
武汉病毒所所披露的信息中也提到涉案申请将通过专利合作条约(PCT)途径进入全球主要国家,由于不同国家的专利法存在差异,某些在中国不被准许授权的内容在国外可以得到授权,例如:澳大利亚、俄罗斯、美国等国家诊断治疗方法是可以授权的;在日本,只要诊断治疗的对象不是人,诊断和治疗方法权利要求也可以授权;欧洲专利局不再承认瑞士型权利要求的合理性,但可以将涉案申请改性为“用于抑制SARS-CoV-2或用于治疗COVID-19的瑞得西韦”,即以产品权利要求的方式进行撰写,该产品权利要求的撰写方式也同样适用于日本;并且欧洲专利局也可以对给药方法(在中国给药方法对瑞士型权利要求和产品权利要求不具有限定作用,也不能写成方法)进行保护。
因此,对于有涉外需求的医药用途申请,需要在说明书中给予适当的布局,撰写出合适保护范围的给药方法、治疗方法和产品权利要求,以保证涉外申请能够在不修改超范围的前提下更容易地修改权利要求以适应各国法律并获取最大的保护范围。
2、涉案申请是否符合创造性要求?
现有的讨论普遍聚焦于瑞得西韦是吉利德(Gilead)针对埃博拉病毒开发的药物。笔者经过检索,发现吉利德的一件专利申请【1】(以下称其为“对比文件”)公开了瑞得西韦在治疗冠状病毒感染所引起的感染性疾病中的应用,可作为最接近的现有技术。对比文件公开文本的权利要求39请求保护一种治疗人类冠状病毒感染的方法,该方法包括给予治疗有效治疗量的式I所示的化合物(式I是一种通式化合物,其包含瑞德西韦的结构式);权利要求65引用权利要求39,其进一步限定所述冠状病毒感染由冠状病毒科病毒所引起;权利要求66中提到所述冠状病毒科病毒选自SARS、MERS……
由此可见,对比文件(US2017071964A1)公开了瑞得西韦对MERS和SARS具有抑制作用,目前我们已知晓引起COVID-19的SARS-CoV-2与MERS和SARS同属冠状病毒亚科 (Coronavirus),因而笔者认为,在本领域技术人员寻求一种能够抑制SARS-CoV-2的药物时,完全有动机根据对比文件所提供的技术启示尝试使用瑞得西韦。
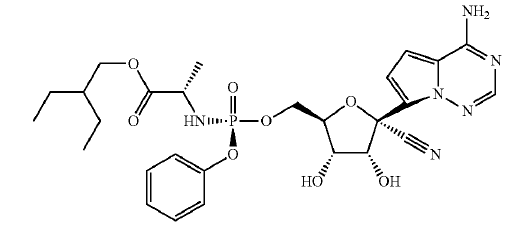
化合物32
此外,对比文件实施例部分的表4进一步验证了化合物32(即瑞得西韦)对MERS和SARS两种冠状病毒的EC50(半最大效应浓度,引起50%个体有效的药物浓度,越小越好)分别为0.074 微摩每升(HAE细胞)和0.03微摩每升(Calu-3细胞),CC50(半数细胞毒性浓度,越小越好)均大于10微摩。而武汉病毒所发表在Cell Research的文章【2】中发现在Vero E6细胞上,瑞得西韦对SARS-CoV-2的EC50=0.77 微摩每升,CC50 > 100微摩。可见涉案申请中瑞得西韦对SARS-CoV-2的抑制效果与MERS和SARS相比在本领域技术人员的预期范围内,并未取得预料不到的技术效果。
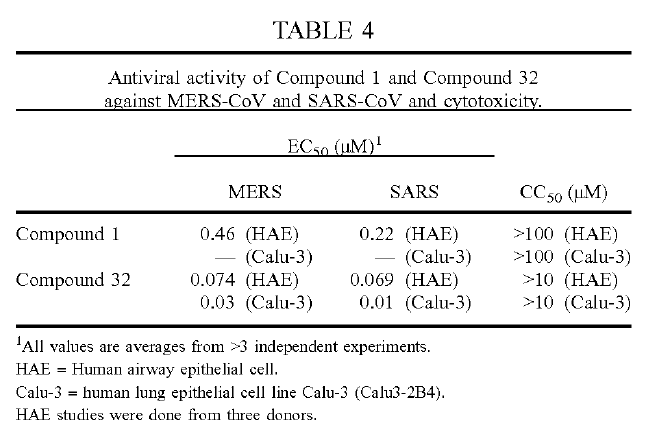
因此,仅根据目前武汉病毒所公开的信息,如果直接申请瑞得西韦在制备用于抑制SARS-CoV-2的药物中的应用,或瑞得西韦在制备用于治疗COVID-19的药物中的应用,可能会因为创造性问题而难以获得授权。
3、如何提高瑞士型权利要求的创造性?
关于瑞士型权利要求创造性的评价,通常可以从以下几个方向切入,与对比文件进行比较与评估:①物质X是否相同或相似;②新用途涉及的Y病(以下称为适应症)是否相同或相似;③药物的剂型是否相同或相似;以及④技术效果。

① 现有物质X
对比文件中的化合物32与瑞得西韦为同一化合物,所以是相同的技术特征。如果发明人进一步验证了瑞得西韦的其他衍生物在抑制SARS-CoV-2时的技术效果,也可以以此方向切入修改权利要求进行创造性的意见陈述。虽然对比文件1中公开了大量的瑞得西韦衍生物,但其实际予以验证的种类却很少。此时创造性的评价标准实际上类似于如何判断选择发明的创造性,在进行选择发明创造性的判断时,选择所带来的预料不到的技术效果是考量的主要因素。相比瑞得西韦,如果申请人验证其衍生物在抑制SARS-CoV-2取得了预料不到的技术效果,则判定涉案申请具有创造性的可能性较大。
② 适应症
SARS-CoV-2与MERS和SARS同属冠状病毒亚科。对比文件权利要求69引用权利要求39,其进一步限定其中冠状病毒科病毒的聚合酶被抑制(即公开了化合物的作用机制),笔者将SARS-CoV-2与SARS基因组经过比对,二者同源性约为82%,这在生物领域并不算很高,如果涉案申请的说明书或现有技术公开了两种病毒的聚合酶序列具有很高的差异,则本领域技术人员就难以合理预期瑞得西韦能够对SARS-CoV-2同样产生抑制作用,此时本领域技术人员难以想到对瑞得西韦进行验证,如果涉案申请的申请文本中同时记载了其他能够抑制SARS或MERS的药物,并且其技术效果均不如瑞得西韦,则说明并非所有对SARS或MERS的抑制类药物对SARS-CoV-2都具有更好的作用,创造性的可争辩空间会更大。
在答复此类案件时,更为常见的思路是进一步细化适应症。对于“瑞得西韦在制备用于治疗COVID-19的药物中的应用”权利要求,如果说明书中记载了在给药对象的种属、年龄、性别等方面进行特别规定时能取得更好的药效,并且现有技术并未对此做出记载,则将这些特征限定入权利要求会使得涉案申请授权变的更为容易,当然所得到的保护范围也会相应大为缩小。
③ 药物
如果发明人发现了特定的药物剂型能取得更好的治疗效果,也可以对权利要求进行补充限定,从而增加创造性。药物的剂型通常隐含了给药方法特征,我们假设,涉案申请的“瑞得西韦在制备用于治疗COVID-19的药物中的应用”权利要求还具有从属权利要求“所述药物的剂型为鼻腔喷雾剂”,继续假设现有技术中瑞得西韦通常通过静脉注射给药或口服给药,且申请人发现鼻腔给药相对于其他给药方法,对于COVID-19的治疗效果最佳,则显然也具备创造性。
④ 技术效果
关于技术效果分析,如果从对比文件所未公开的角度切入效果最佳。假设对比文件未公开冠状病毒对瑞得西韦的耐药性如何,而涉案申请发现SARS-CoV-2对瑞得西韦很难产生耐药性,即便多次给药,药效也未发生显著降低,也可以认为取得了预料不到的技术效果,进而符合创造性的相关规定。
笔者从以上四个方面提供了一些思路供读者参考,特别是在处理包含此类型权利要求的案件时可以考虑从哪些方面建议发明人补充实验数据或进行答复会更有利于授权。概言之,只要能够对瑞士型权利要求产生限定作用的技术特征,都可以作为创造性评价的切入点。
4、对于涉案申请中的“瑞得西韦在制备用于治疗COVID-19的药物中的应用”权利要求,其是否能够得到说明书的支持?
专利法第二十六条第四款规定,权利要求书应当以说明书为依据,清楚、简要地限定要求专利保护的范围。专利法第二十六条第四款中有关权利要求应当得到说明书支持的规定的立法本意在于平衡专利权人与公众利益,专利权人所得到的权益应当与其实际所做的贡献相匹配。从武汉病毒所公开的信息中可以看出,其目前仅验证了瑞得西韦对SARS-CoV-2抑制作用的体外实验(in vitro),并未验证动物模型的体内实验及人体用药实验。《专利审查指南》第二部分第二章第3.2.1节明确规定,权利要求书应当以说明书为依据,是指权利要求书应当得到说明书的支持。权利要求书中的每一项权利要求所要求保护的技术方案应当是本领域技术人员能够从说明书中公开的内容得到或者概括得出的技术方案,并且不得超出说明书公开的范围。如果权利要求的概括包含申请人推测的内容,而其效果又难于预先确定和评价,应当认为这种概括超出了说明书公开的范围。既然该权利要求请求保护的是对于疾病的治疗,则不仅应对疾病的体外细胞、动物模型实验有效,还应当达到能够有效治疗人体患者的程度。从这一点看,其似乎得不到说明书的支持。
生物医学领域由于生命活动的复杂性,其技术效果的可预测性较低,所以说明书实施例和实验数据处于突出的重要地位。因此,如何从本领域技术人员的视角出发结合案情进行分析,以及如何充分说理通常是对该条款审查的难点问题。笔者认为,一个权利要求书到底是否以说明书为依据,其判定主体应当为本领域技术人员,并需要具体情况具体分析,不能简单地以实施例的多寡和详细程度来判断。
在“胃肠基质肿瘤的治疗”发明专利权无效宣告请求案”【3】中,合议组认为对于以“某物质在制备用于治疗某疾病的药物中的应用”形式撰写的医药用途权利要求,“治疗某疾病”应理解为对患有某疾病的患者进行治疗,其中“患者”既包括病人,也包括动物患者。尽管如此,在说明书中提供临床试验数据并不是为此类医药用途权利要求提供支持的唯一方式,在说明书中提供体外细胞实验或动物模型实验也是可选方式,但采用这些方式时应达到使本领域技术人员根据说明书提供的内容能够预期该物质具有所述用途和/或效果的程度。换言之,若权利要求请求保护药物对人体患者进行治疗,其支持程度并不意味着在临床试验时能够达到绝对的成功,而只需使得本领域技术人员对以该药物治疗人体患者的成功性有合理的预期即可。
笔者认为,对于涉案申请,即使说明书中仅给出体外细胞试验而没有动物模型试验或人体临床试验,该权利要求应该也是能够得到说明书支持的。瑞士型权利要求往往保护的是“二次用药”,具体在本案中,瑞得西韦在我国和国外都早已经过临床验证,其副作用、药物动力学参数等均为人们所知,且对于抗病毒药物,极少出现体外实验与临床试验中的抑制效果显著不一致的情况。另外,在申请日(1月21日)之前,现有技术中已经披露了导致COVID-19的病原体即为SARS-CoV-2,因而本领域技术人员根据体外细胞实验可以预期其在COVID-19的治疗中应该能够产生疗效。实际上,根据笔者的实务操作经验,即便对于首次用药的新药物,如果体外实验数据并没有产生很大的不可预见性(例如在不同细胞、不同给药方式和不同处理条件中实验数据药效没有产生异常波动,或者药物作用的机理研究中没有预示体外和体内疗效会出现相悖现象的证据),审查员一般也不会就支持问题做过多纠结。
5、如果涉案申请能够授权,其能够具有怎样的保护效力?
有观点认为瑞士型权利要求相对于药物产品权利要求和治疗方法权利要求而言,专利价值非常有限。对于能够产生产品的制备方法权利要求,由于如果其制备得到的产品不具有新颖性和创造性,那么由该方法直接制备得到的产品也无法得到延及保护,因此瑞士型权利仅在于防止制药过程,并阻止他人对该用途申请专利,宣传作用大于实际保护作用。
在以往的判例【4】中,北京高院也曾认为,“化合物X作为制备治疗 Y病药物的应用”与“治疗Y病的药物的制备方法,其特征在于应用化合物 X”是完全等价的。医药用途发明权利要求通常包括药品物质特征、药品制备特征及疾病适应症特征,而医生的治疗行为仅仅涉及如何使用药物的技术特征,不涉及药品制备特征,不会侵犯专利权。
该观点也暗示了瑞士型权利要求无法延及保护产品。但是,中国不是判例法国家,因此北京高院在个案中的司法观点对复审委在审理相关的其他专利案件时没有约束力。
在2019年重庆华邦制药有限公司、阿斯利康(瑞典)有限公司侵害发明专利权纠纷二审判决【5】中,最高院认为瑞士型权利要求属于制药方法类型的用途权利要求,为了保护发明人对现有技术的创新性贡献,实现专利法保护创新、鼓励发明创造的立法宗旨,国务院专利行政部门允许将那些发明实质在于药物新用途的发明创造,撰写成制药方法类型的权利要求来获得专利权,如“化合物X作为制备用于治疗Y病的药物的应用”或类似的形式,其实质上是针对物质的医药用途发明创造所作的特别规定。所以,本案中,依照涉案专利方法直接获得的产品是阿那曲唑药物,依照该专利方法直接获得的产品的使用、许诺销售、销售、进口等行为均属于侵权行为。
这说明,在我国,对瑞士型权利要求的解读更为普遍的观点是认为其保护范围涉及药品的制备,既包括活性成分本身的制备,也包括非活性成分或原料药的制备,以及药品出厂包装前的所有工序。且,鉴于其是一种针对新适应症药物的制备方法,因而对其做出了特别的规定,可以延及保护根据该方法直接制备获得的产品(针对新适应症的药物)。
因此,虽然在专利布局时,瑞士型权利要求一般作为防御性专利,在药物产品权利要求授权之后用于延长药物专利的保护期,但其在专利保护效力上也并非很弱。
谈及此,可能有读者会产生困惑,以本文所讨论的问题为例,若瑞士型权利要求延及药品本身的保护,如果涉案专利授权,岂不是吉利德和武汉病毒研究所都具有瑞德西韦的专利权?该顾虑大可不必,根据已有的判例,只有用于抑制SARS-CoV-2病毒或治疗COVID-19的药物的产品才会落入涉案申请的保护范围内。瑞士型权利要求对竞争对手在法律上具有约束力,至少竞争对手不可在未获得许可的情况下在瑞德西韦药物的包装和说明书中印上其可以抑制SARS-CoV-2病毒或治疗COVID-19,也不可宣传其可以用于抑制SARS-CoV-2病毒或治疗COVID-19。实际上,此前也曾有侵权判例对药品说明书的适应症和宣传资料进行取证以进行瑞士型权利要求的侵权认定并胜诉的先例【6】。
由于药物是一种非常特殊的产品,若其需要上市,需要临床试验审批、新药上市审批、上市后再审判等多重手续,并且审批和销售过程中势必要对适应症进行披露,因而其维权取证相对来说非常简单。另外,由于吉利德持有瑞德西韦的产品专利权,武汉病毒所若想要实施其专利,也需要获得吉利德的许可,吉利德也可与武汉病毒所采用专利交叉许可协议的方式生产销售用于抑制SARS-CoV-2病毒或治疗COVID-19的药物。
6、瑞士型权利要求的专利布局策略
虽然在支持问题的讨论中提到“瑞得西韦在制备用于治疗COVID-19的药物中的应用”能够得到说明书的支持,但对于很多其他类型的药物来说,往往也至少需要动物体内实验才能保证权利要求得到支持,具有足够的稳定性;另外,上文中笔者也提到,如果能够补充额外的实验证据则更加有助于涉案申请的授权,因而理想状态下会建议申请人多做一些额外的工作进行验证。这两条因素都导致大部分瑞士型权利要求技术方案的研发周期是比较长的。
但是,瑞士型权利要求保护的是“二次用药”,这导致其是一种典型的“一望便知”的权利要求,很难迷惑竞争对手,反向解构难度极低。一旦方案公开,瑞士型权利要求就很容易失去新颖性和创造性,并且竞争对手几乎马上就可以对其进行侵权。
因而瑞士型权利要求专利申请方面基本需要考虑的诉求是:一方面是对保密要求非常高,一方面是研发周期较长但尽量获得先机。显然这是一种很适合使用优先权进行保护的权利要求类型。
专利优先权是指专利申请人就其发明创造第一次提出专利申请(在先申请)后,在法定期限内,又以相同主题的发明创造提出专利申请(在后申请)的,其在后申请以第一次专利申请的日期作为其申请日,就是优先权。专利优先权可分为国内优先权和国际优先权,对于发明专利而言,在先申请与在后申请的法定期限间隔可达12个月。
在涉案申请的例子中,对于COVID-19相关药物的研发在当前处于争分夺秒的状态,瑞士型权利要求中技术特征极少,申请日一旦落后很有可能造成抵触申请而不具有新颖性,或者因现有技术的公开而失去创造性。因而对于武汉病毒所而言,一旦所掌握的实验数据足够支持权利要求,就马上提交申请得到申请日是一种非常明智的选择,如果需要进一步补充实验数据,可以在12个月内完成数据的准备,并通过要求在先申请优先权的方式使得专利文本创造性更高,稳定性更好。并且这种操作也使得那篇Cell Research文章的发表的online时间晚于申请日,对专利的新创性不会造成影响。
对于瑞士型权利要求,申请人的诉求也常常是能够尽量推迟竞争对手得知其研究内容的时间,在市场上得到先机。那么也可以采用国际优先权的方式延缓其技术内容公开。国际优先权可通过巴黎公约以及PCT途径进行要求,以PCT为例,申请人可以先注册一个不引人注意的小公司,以该公司名义将其技术内容在一个相对不那么引人注目的国家以相对难以被检索到的语言进行申请,例如可选在越南以越南语进行申请,不要提前公开,并在自优先权日起30个月后通过PCT途径进入中国、美国、欧洲、日本等国家和地区,并且在此期间申请人也可以随时主动撤回其专利申请。通过上述方法,可以大大推迟专利信息的公开时间(小语种即便公开检索难度也非常大),竞争对手对申请人进行专利分析的难度大为增加,可以为申请人提供充足的时间进行市场调研,销售链安排等工作,占尽先机。
结语
中国医药市场规模排在全世界第二位,但是创新药的数目只占全球6%,目前仍然以仿制药为主。在未来的很长一段时间内,“二次用药”可能都是国内医药企业创新研发的重要方向之一。虽然欧洲专利局上诉委员会已于2010年作出决定,不再承认瑞士型权利要求的合理性,但在目前我国医药行业的发展现状下,瑞士型权利要求仍然是一种可以较多采用的专利保护方式。因此,无论从撰写的创造性角度、侵权和维权的角度,如果能够充分理解并合理的使用瑞士型权利要求,都可以发挥出不小的作用,不仅能够保护中国医药企业权利人的利益,也能够促进行业的持续健康发展。
参考资料:
【1】申请号为US2017071964A1,申请日2016年09月16日,公开日2017年03月16日,最早优先权日2015年09月16日。
【2】Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Research (2020). Manli Wang et al.
【3】 北京市高级人民法院 (2017) 京行终2871号行政判决书。
【4】北京高院(2008)高行终字第378号行政判决书。
【5】(2019)最高法知民辖终319号民事裁定书。
【6】(2003)南市民三初字第75号民事判决书。
来源:IPRdaily中文网(iprdaily.cn)
作者:信建 华进国内专利事业部北京生物与化学部主管
编辑:IPRdaily王颖 校对:IPRdaily纵横君

「关于IPRdaily」
IPRdaily成立于2014年,是全球影响力的知识产权媒体+产业服务平台,致力于连接全球知识产权人,用户汇聚了中国、美国、德国、俄罗斯、以色列、澳大利亚、新加坡、日本、韩国等15个国家和地区的高科技公司、成长型科技企业IP高管、研发人员、法务、政府机构、律所、事务所、科研院校等全球近100多万产业用户(国内70万+海外30万);同时拥有近百万条高质量的技术资源+专利资源,通过媒体构建全球知识产权资产信息第一入口。2016年获启赋资本领投和天使汇跟投的Pre-A轮融资。
(英文官网:iprdaily.com 中文官网:iprdaily.cn)
本文来自IPRdaily中文网(iprdaily.cn)并经IPRdaily.cn中文网编辑。转载此文章须经权利人同意,并附上出处与作者信息。文章不代表IPRdaily.cn立场,如若转载,请注明出处:“http://www.iprdaily.cn/

 共发表文章7603篇
共发表文章7603篇文章不错,犒劳下辛苦的作者吧
- 我也说两句
- 还可以输入140个字













