没收到验证邮件?请确认邮箱是否正确或 重新发送邮件

#本文由作者授权发布,未经作者许可,禁止转载,本文仅代表作者观点#
发布:IPRdaily中文网(IPRdaily.cn)
作者:邱福恩 国家知识产权局条法司
供稿:钨石谷平台(ID:wushivalley)
原标题:深度解码专利链接:创新药企、仿制药企你们准备好了吗?
国家知识产权局条法司专家邱福恩在“钨石生物医药知识产权峰会”上发表了题为《药品专利链接制度介绍及几点思考》的主题演讲,从立法本义和实施效果评价两方面进行了剖析。
背景回顾
2017年10月8日,中共中央办公厅、国务院办公厅联合印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(以下简称《意见》),引发了知识产权、医药、投资机构、法律界的一波大讨论。
国家知识产权局条法司专家邱福恩在“钨石生物医药知识产权峰会”上就此发表了题为《药品专利链接制度介绍及几点思考》的主题演讲,从立法本义和实施效果评价两方面进行了剖析。以下是演讲内容文字记录稿(经修订):
《意见》的15-19条给出了药品专利链接制度的整体框架设计,未来还将进一步细化具体的制度设计。该意见中第16项明确提出要探索建立药品专利链接制度,这是我国首次明确提出要建立专利链接制度。以下对相关制度的介绍和解读均仅代表个人观点。
制度介绍
专利链接制度的历史沿革
药品专利链接制度起源于美国。1984年,美国通过了著名的Hatch-Waxman法案,该法案包括ANDA(简略新药申请)、药品专利链接制度、药品专利保护期补偿、Bolar例外、数据保护等几个方面。
此后,加拿大、澳大利亚、韩国等国家通过与美国签定自由贸易协定,相继引入了专利链接制度,但欧盟、瑞士、日本、印度至今尚未建立这样的制度。
美国链接制度流程
美国链接制度从整体上可以分为4大块:桔皮书制度、专利声明制度、遏制期制度、首仿药市场独占期制度。
首先来看桔皮书制度。这一制度要求原研药企业在申请药品上市时需要提交专利信息,在原研药上市之后,FDA(美国食品药品监督管理局)会将相关专利信息登记在桔皮书中。桔皮书的信息提供了专利链接制度的基础。12月28日,食品药品监督管理总局发布了我国第一批上市药品目录集,类似于美国的桔皮书,在目录集后的附录里收录了药品相关专利。
仿制药提出申请时,就要针对桔皮书里面列出的每一个专利,做出专利声明。美国的专利声明可以划分称为两大类,第一大类就是我们通常所谓的certification,另外一大类包括两个statement。
通常certification包括四小类:第I段声明是,桔皮书里面没有列出相关专利;第II段声明是,桔皮书所列出的专利已经过期;第III段声明是,桔皮书所列的专利过期前仿制药不会上市;第IV段声明是最重要、最核心的一类声明,即声明桔皮书所列的专利无效、不可实施或者生产上市仿制药不会侵犯专利权,也就是我们通常所称的“专利挑战”。
再看那两个statement。第一个statement也称为小viii项声明,针对的是药品使用方法专利。如果一个原研药有多个适应症,只有部分适应症是受专利保护的情况下,仿制药企业可以在其仿制药上市申请中将受到专利保护的适应症删除,即不寻求获得批准受专利保护的适应症,那这个仿制药就不会侵犯该使用方法专利,这个时候可以作出这样的声明。第二种statement是没有专利的声明,可以声明说没有专利。
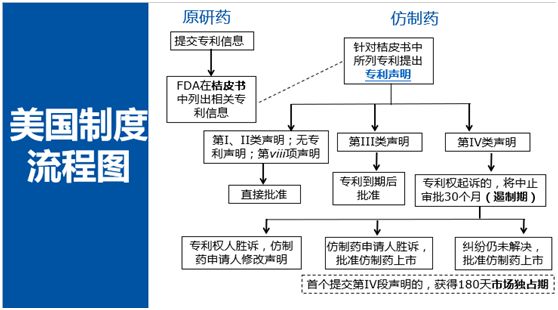
无专利statement和第I段certification有什么区别呢?根据FDA的解释,如果作出的是无专利statement,就是指仿制药申请人认为不存在相关专利;而提出第I段certification则是指仿制药申请人认为存在相关专利,但是在桔皮书中没有列出。
收到仿制药申请人的专利声明之后,FDA会根据不同的声明做出相应的处理。如果提出的是第I、II段声明、以及无专利的第viii项声明的情况下,FDA会直接批准;如果提出的是第III段声明,FDA会在专利到期后批准;如果仿制药企业提出的是第IV段声明(专利挑战),则仿制药企业需要通知专利权人及原研药企业,专利权人在收到通知之后45天之内可以起诉,起诉的话就进入了一个非常重要的程序---遏制期,这个时候FDA会中止审批长达30个月,但是不会停止接受审评,中止审批的目的是等待法院解决专利侵权纠纷。如果在30个月以内,法院判定专利权人胜诉,也就是仿制药侵犯专利权,那么仿制药不能直接获得审批,一般会要求仿制药申请人修改声明,即需要等到专利过期之后才能获得上市许可。如果专利挑战成功了,也就是仿制药企业胜诉,在判决做出后,FDA会直接审批上市。如果等到了30个月,诉讼仍未解决,那么FDA也会批准仿制药上市。这就是整个链接制度的流程。
此外,还有一个非常重要的制度---首仿药的市场独占期制度,指的是首个提交专利挑战的仿制药企业可以获得180天的市场独占期。
实际上,我们国家的链接制度的整体框架设计和美国的框架是一样的,虽然还有许多地方需要进一步细化。
主要国家链接制度比较
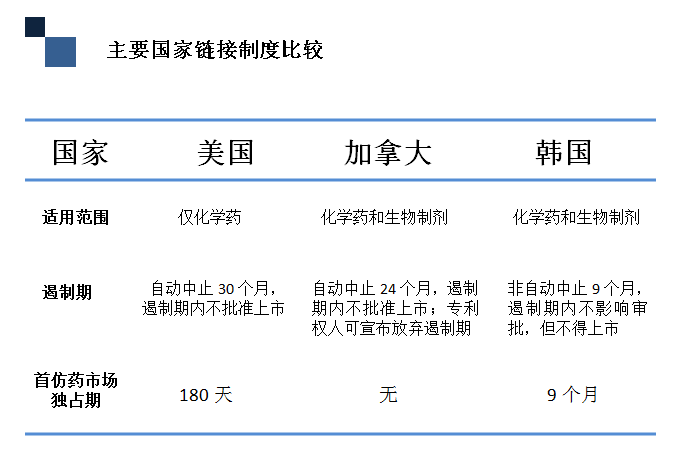
从制度框架上来看,美国、加拿大、韩国的链接制度基本一样,只是细节上存在区别。第一个较大的区别是适用范围,美国的链接制度只适用于化学药,而加拿大、韩国除了化学药外还适用于生物制剂。第二个区别是遏制期不同,美国的遏制期长达30个月,加拿大是24个月,韩国9个月。值得注意的是,在加拿大的专利链接制度中,专利权人可以放弃遏制,后面会讲到在什么情况下会选择放弃。第三个区别是首仿药市场独占期,美国为180天,加拿大没有独占期,韩国是9个月。
既然美国的生物类似物不适用于专利链接制度,那生物类似物上市遵循怎样的流程呢?美国有一套独特的制度叫“专利舞蹈”(Patent Dance)。这项制度是通过2009年《生物制品价格竞争和创新法案》所建立的一套制度,2010年生效。这项制度非常有意思,它要求在生物类似物上市申请受理之后,上市申请人和参比制剂企业 (PRS)通过一系列的程序,互相交换信息,交换专利清单,对所涉及的专利进行协商,以就专利清单达成一致。
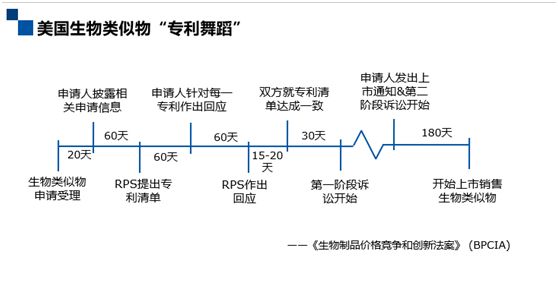
从上图可以看到,申请人走一步,PRS走一步,申请人再走一步,PRS再走一步,这样一来一回,非常像两个人在跳舞,所以被称为“专利舞蹈”。在跳完这场舞之后,专利权人就可以可以开始第一阶段诉讼。但与链接制度有很大区别的是,尽管专利权人可以在生物类似物上市审批期间提起第一阶段诉讼,但是诉讼不影响生物类似物的上市审批。接着从生物类似物企业计划上市销售生物类似物这个时点往前推180天,申请人需要发出上市通知,PRS在收到上市通知之后,可以开始第二阶段诉讼,期间可以请求临时禁令。
制度实施效果
实施效果
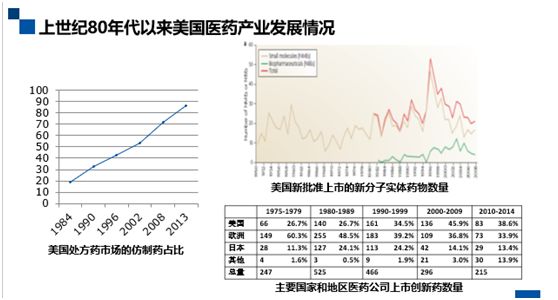
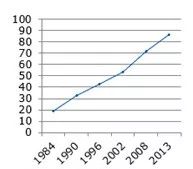
*美国处方药市场的仿制药占比
从这张PPT可以概览美国上世纪80年代以来医药产业发展的整体情况。左边的小图显示,1984年以来,美国处方药市场上仿制药的占可以说是急剧升高。例如,在1984年时,只有18%,到了2013年就已经达到了86%。右上角的这张图展现了美国创新药产业的发展情况,图中显示了各个年份美国新批准上市的新分子实体药物数量。
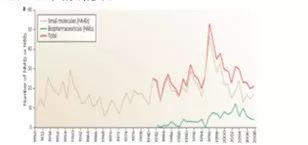
*美国新批准上市的新分子实体药物数量
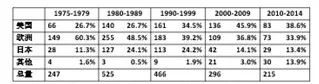
*主要国家和地区医药公司上市创新药数量
从图中可以看出,1984年Hatch-Waxman法案推出之前,美国医药产业的水平本身就已经相当高了,法案出台后,新分子实体药物数量有所增长,但是不是特别明显。从右下角的表格,可以一窥不同年份主要国家和地区医药公司上市创新药的数量及占比。上个世纪七八十年代,美国位列全球第二,占全球上市创新药数量的1/4(26.7%),到了九十年代就超过了1/3,虽仍然落后于欧洲但缩窄了差距。 2000-2009年,美国的公司上市的新药数量已经占到了全球的45.9%,超越了欧洲成为了最大的创新药市场来源地。以上就是美国的仿制药和创新药的发展情况。
可以看出,美国从上个世纪八十年代以来,无论是创新药还是仿制药,发展的都很迅猛,那这与专利链接制度到底有怎样的关系呢?

从制度层面来看,美国医药产业的发展是多种制度共同作用的结果,很难简单地说是哪一个制度促进了美国医药产业的发展。即使以上图中简单的公式“Y=N1*X1+N2*X2……+Nn*Xn”来看,对于仿制药产业而言,影响它发展的因素至少包括以下几个方面:第一是简化了仿制药申请和审批程序、降低了成本的ANDA制度,我个人认为这是最重要的一点;第二是大家都熟悉的Bolar例外制度;第三是专利链接制度;第四是美国八十年代基本上50个州都出台了“仿制药替代法”,旨在鼓励甚至要求用仿制药来替代原研药,除非医生明确说只能用原研药。最后还有一点虽不属于制度因素,但也十分重要,即这几十年来大量的专利到期,这显然也会影响到仿制药的占比。
对于创新药来说,从知识产权制度来看,促进它发展的因素是多重的,比如药品数据保护,专利保护期限延长以及专利链接制度。客观的说,药品专利链接制度对产业的发展到底起了一个什么样的作用呢,我们很难从数据里面去得出一个确切的答案。
几点思考
个人思考
所以我们可能还得回归到制度本身,就这个制度本身谈几点我个人的思考。

01、公示专利信息
通过桔皮书制度,公示药品相关专利信息,有利于专利保护和仿制药企业制定生产上市计划
02、提前解决专利纠纷
专利纠纷的解决时机提前至药品上市审批阶段,有利于侵权纠纷的及早解决,既有利于专利保护,又有利于提前上市仿制药的法律确定性
03、鼓励“专利挑战”
通过对首仿要给予一定时间的市场独占期,鼓励仿制药企业提出专利挑战,有利于仿制药及早上市
积极效果
首先从制度设计上看一下专利链接制度的积极效果,或者至少是说政策制定者希望达到的效果。概括起来有以下三方面,第一是通过桔皮书制度公示了专利信息,既保护专利,也利于仿制药企业制定生产上市计划,对于投资机构来说,这也是非常重要的。我国没有桔皮书制度时候,实践中很多企业是通过美国的桔皮书倒推来看某个相同药物在中国有没有受到专利的保护。第二是可以提前解决专利纠纷,在没有链接制度时候,专利权人只能是在药品上市之后才能起诉,通过诉讼解决专利纠纷,但是根据药品专利链接制度,可以将纠纷的解决提前至药品上市审批阶段,有利于侵权纠纷的及早解决,既有利于保护专利权人合法权益,对仿制药企业而言也可以提高上市仿制药的法律确定性。第三是通过给予首仿药市场独占期,可以鼓励“专利挑战”,对于仿制药及早上市是有非常积极作用的。
上市仿制药仍然存在侵权可能
值得注意的是,链接制度设计本身存在一些问题,同时还可能被滥用。首先,从制度效果上来说,链接制度希望能提前解决专利纠纷,提高仿制药上市的确定性,但链接制度在解决专利纠纷方面的效果是有限度的,它并不能解决所有专利纠纷。也就是说,即使有了链接制度,上市以后的仿制药仍然有可能面临专利纠纷,因为链接制度针对的是桔皮书里面所列出来的专利,但是这些仅仅是一部分专利,包括化合物、组合物、剂型以及药品的使用方法(我国称之为制药用途),没有列进桔皮书里面去的就不能适用链接制度了,那么也就意味着即使通过链接制度把这些桔皮书列出来的专利纠纷都解决了,还是可能面临未列入桔皮书其它专利的侵权纠纷(比如说制备方法)。
再者,美国以及很多国家的制度设计是一审判决不侵权就可以上市,也就是地区法院判决不侵权就可以批准上市,那么要是一审判决后二审判决改判了呢?30个月,24个月还是9个月的遏制期届满后,专利纠纷还是没有解决,药品审批机关也会批准仿制药上市,但如果仿制药企业上市销售其仿制药产品的话,也可能也会面临侵权责任。还有如果专利权人在仿制药审批阶段不提起诉讼呢?也就是说,链接制度只是提供给专利权人一个在仿制药审批阶段提起诉讼的机会,但如果专利权人不利用这个机会,而是等到仿制药企业已经生产销售仿制药之后再起诉的话,即所谓的“放水养鱼”,仿制药企业上市其仿制药后仍然存在法律不确定性。在链接制度实践过程中,在美国、加拿大发生过这样的问题。
美国在2003年后修改了药品专利链接制度, 规定如果专利权人在药品链接阶段不起诉的话,仿制药申请人可以提起确认不侵权之诉。而加拿大在2017年修改其专利链接制度后,则明确如果专利权人没有在规定期限内起诉的话,此后再也不能就相同专利起诉该仿制药企业。
专利挑战和“遏制期”
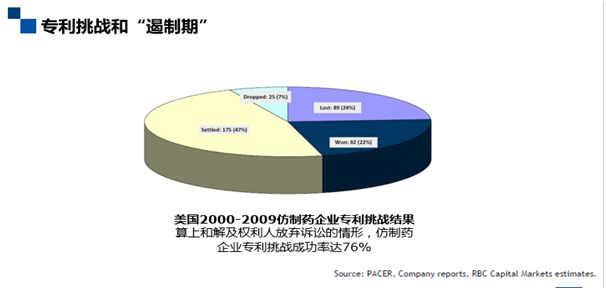
我们来看图上的这组数据,其显示的是美国2000年到2009年仿制药企业专利挑战的结果。结果有四种:法院判决(输/赢)、和解、权利人放弃。据统计,仿制药企业专利挑战成功率达76%(赢+和解+权利人放弃),超过四分之三(不同年份的统计数据,基本上是差不多的),那么怎么解读76%这么高的一个挑战成功率呢?一方面,我们可以说专利链接制度确实起到了鼓励仿制药企业提出专利挑战的作用。但另一方面,这么高的挑战成功率也促使我对遏制期制度的设计进行了反思。
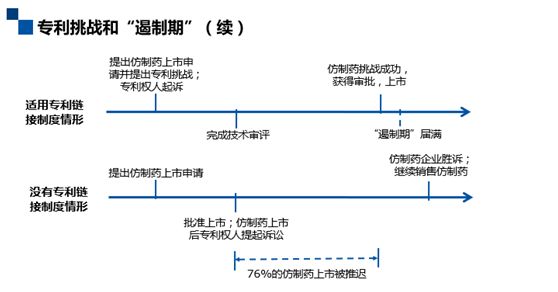
我们首先比较一下,在有链接制度和没有链接制度的情况下,对于这76%挑战成功的仿制药药企而言会有什么影响。从上图可以看出,在适用专利链接制度的情况下,如果仿制药药企提出专利挑战,那么即使上市审批机关完成了技术审评,但受制于专利的侵权纠纷及遏制期,仿制药依然不能直接上市,而一定要等到纠纷解决完,也就是说专利挑战成功或者遏制期满后才能上市。
另一方面,在没有专利链接制度的情况下,在技术审评之后仿制药马上可以获得批准上市,上市后专利权人就可以提起诉讼。假设在专利权人没有提起临时禁令的情况下,仿制药品完全可以继续销售,而对于76%中的仿制药药企而言,由于最终其将取得胜诉,也不可能需要承担任何赔偿责任。
两种情况一对比,就会发现这76%的仿制药会被药品专利链接制度推迟很长一段事件才能上市。这就促使我们会去思考一个问题,这种现象到底是合理的还是不合理的。合理不合理我们来看一下遏制期的法律性质。

遏制期实际上是在法院还没有确定仿制药是否侵权的情况下,即禁止仿制药上市,因此其在法律效果上与临时禁令完全相同。但与临时禁令不同的是,遏制期的适用无需专利权人提供任何形式的担保,而且即使专利权人败诉也不需要承担赔偿责任。对于上述统计的76%挑战专利成功的仿制药药企而言,其仿制药的上市时间会因遏制期的适用而被推迟,从而造成一定的损失,但专利权人无需对此承担任何赔偿责任。所以遏制期的本质上是一个门槛极低的自动临时禁令。因此,对于链接制度而言,遏制期的设置是其中的关键,首先时长的设置要合理,太长会导致大幅延迟仿制药上市的时间;其次,需要合理平衡专利权人和仿制药药企的权利义务。
这方面加拿大的经验值得借鉴,该国链接制度规定,如果最终专利权人败诉,需要承担因遏制期给仿制药企业所造成的直接损失。2017年9月,加拿大修改了其专利链接制度,修改以后,专利权人需要赔偿的损失不仅包括直接损失,还包括间接损失。也就是说,例如,仿制药企业可以主张由于仿制药上市时间被推迟,导致其市场份额被挤占,从而造成了间接损失,专利权人应当予以赔偿。这种情况下,就给予了专利权人比较高的义务,从而能够有效避免遏制期的滥用。同时,为了平衡双方权利义务,修改后的链接制度还规定,专利权人也可以放弃遏制期主张,以避免承担赔偿责任。
最后简单的谈一下首仿药市场独占期。一直以来,市场独占期都是药企非常关注的制度,独占期对于专利链接制度来说也是非常关键的。
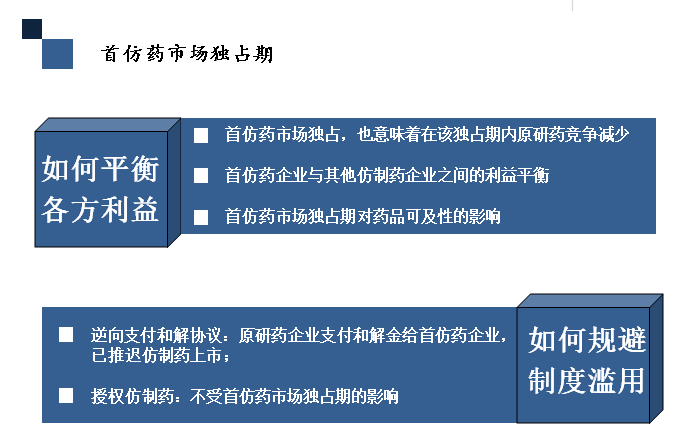
从制度设计上来说,这当中有几个难点,第一是如何平衡首仿药企业、仿制药企业和专利药企业之间的利益。实际上,首仿药市场独占意味着市场上仿制药竞争较少,专利药也会因此受益,因为如果只有一个仿制药的话,专利药市场份额应该也会较高。同时,首仿药企业和其他仿制药企业之间的利益也需要平衡考虑。第二个问题是公共利益和医药企业利益之间的平衡,过长的首仿药独占期无疑会对药品可及性造成影响。
此外,首仿药市场独占期制度在美国也遇到了一些问题。第一个是反向支付和解协议,即原研药企业或者专利权人反向支付和解金给首仿药企业。这是为什么呢?因为首仿药企业有180天的独占期,而这个市场独占期又是从首仿药的上市开始计算。也就是理论上来讲,只要首仿药企业不上市仿制药,其他的仿制药企业根本也不可能上市,在这种情况下,原研药企业为了保住自己的市场份额,就会支付和解金给首仿药企业,换取首仿药企业推迟仿制药上市。另外一个是授权仿制药,也就是原研药企业可以自行销售或授权其他企业销售与其原研药完全一样的仿制药,而授权仿制药的上市许可不会受到180天市场独占期的限制。在这种情况下,首仿药180天市场独占期的激励效果就会大打折扣。反向支付和解协议和授权仿制药涉及更为复杂的问题,由于时间关系,在此不作详述。
发布:IPRdaily中文网(IPRdaily.cn)
作者:邱福恩 国家知识产权局条法司
供稿:钨石谷平台(ID:wushivalley)
编辑:IPRdaily赵珍 校对:IPRdaily纵横君
推荐阅读
“投稿”请投邮箱“iprdaily@163.com”

「关于IPRdaily」
IPRdaily成立于2014年,是全球影响力的知识产权媒体+产业服务平台,致力于连接全球知识产权人,用户汇聚了中国、美国、德国、俄罗斯、以色列、澳大利亚、新加坡、日本、韩国等15个国家和地区的高科技公司、成长型科技企业IP高管、研发人员、法务、政府机构、律所、事务所、科研院校等全球近50多万产业用户(国内25万+海外30万);同时拥有近百万条高质量的技术资源+专利资源,通过媒体构建全球知识产权资产信息第一入口。2016年获启赋资本领投和天使汇跟投的Pre-A轮融资。
(英文官网:iprdaily.com 中文官网:iprdaily.cn)

本文来自钨石谷平台并经IPRdaily.cn中文网编辑。转载此文章须经权利人同意,并附上出处与作者信息。文章不代表IPRdaily.cn立场,如若转载,请注明出处:“http://www.iprdaily.cn/”

 共发表文章4691篇
共发表文章4691篇文章不错,犒劳下辛苦的作者吧
- 我也说两句
- 还可以输入140个字















