没收到验证邮件?请确认邮箱是否正确或 重新发送邮件

#本文由作者授权发布,文章仅代表作者观点,不代表IPRdaily立场#
发布:IPRdaily中文网(IPRdaily.cn)
作者:鲁礼炎 隆安(上海)律师事务所 合伙人律师 专利代理人 知识产权律师公众号
原标题:百亿级重磅大药LCZ696遭遇专利阻击,组合物专利被宣告全部无效--简评含有缬沙坦和NEP抑制剂的药物组合物专利无效案
医药专利对于医药企业的来说是非常重要的资产,而且一项发明的产生,需要科学家及技术人员通过大量的实验获得,付出的成本很高。而专利实际上是对之前所有付出及成果的汇总与保护。千万不要过于吝惜这临门一脚投入,应当精心策划、充分检索、做好战略布局、认真撰写,才能获得一件高质量的专利,成为企业真正的资本和核心竞争力。
诺华重磅心衰药物沙库巴曲缬沙坦钠片遇挫。1月3日,国家知识产权局专利复审委员会发布诺华重磅药物Entresto(沙库巴曲缬沙坦钠片,LCZ696)的组合物专利审查结果:专利权人诺华股份有限公司的发明创造《含有缬沙坦和NEP抑制剂的药物组合物》“宣告专利全部无效”。
LCZ696是一种治疗心衰的药物,2015年7月获得了美国FDA批准上市,同年11月获得欧盟批准。2017年7月,诺华宣布Entresto(沙库巴曲缬沙坦钠片,LCZ696)正式获得CFDA批准在中国上市,用于射血分数降低的成人慢性心衰患者,以降低其心血管死亡和心衰住院的风险。
LCZ696一度被诺华作为重整心血管市场的重磅大药打造,分析师预测其金额将高达100亿美元。
如此被市场看好的重磅大药,也是众多药企虎视眈眈的领域。如果专利布局被攻破,意味着市场将有可能会被瓜分。国家食药总局药品审评中心显示,针对沙库巴曲缬沙坦钠片,四川青木制药、成都苑东生物制药申请化药2.1类新药临床试验申请,受理号分别为CXHL1700256、CXHL1700257、CXHL1700258。
当然,对于诺华而言,其依然有权在3个月内向北京知识产权法院起诉寻求救济。
本文对该专利无效决定进行了简要解读,并就一下问题进行简要评析, 抛砖引玉,共同探讨:
1.联合用药专利和复方制剂的区别及专利保护应注意的问题
2.实验数据在证明取得意料不到的技术效果的标准问题
3.申请日后补充的实验数据的接受及证明力问题
一、决定要点
1、如果一项发明存在多个要解决的技术问题,并不要求其必须解决说明书记载的所有要解决的技术问题,只要其解决了所保护的技术方案要解决的其中一个技术问题,对该技术方案而言就达到了充分公开的要求。
2、权利要求保护范围的边界是否清晰与保护范围大小无关。判断权利要求保护范围的概括是否合理,应考察其与发明创造的技术贡献是否相称,针对的往往是具有授权前景的技术方案,如果发明与现有技术相比未达到显而易见,则判断权利要求概括是否恰当并无意义。
3、申请日后补交的实验数据不属于专利原始申请文件记载和公开的内容,这些实验数据也不是专利的现有技术的内容,根据先申请制原则和专利制度以公开换保护的本质,接受这些数据的前提必须是其所证明的技术效果能够从原说明书中得到。
二、案件无效背景
本案涉及诺华药物Entresto(沙库巴曲缬沙坦钠片,LCZ696),为诺华重整心血管领域雄风的重磅新药,主要用于心力衰竭的治疗。
LCZ696是一种治疗心衰的药物,2015年7月获得了美国FDA批准上市,同年11月获得欧盟批准。2016年2月,诺华向中国国家食品药品监督管理总局(CFDA)提交了上市申请,同年12月被CDE以“与现有治疗手段相比具有明显治疗优势”的理由纳入了优先审评。
去年7月,诺华宣布Entresto(沙库巴曲缬沙坦钠片,LCZ696)正式获得CFDA批准在中国上市,用于射血分数降低的成人慢性心衰患者,以降低其心血管死亡和心衰住院的风险。
LCZ696一度被诺华作为重整心血管市场的重磅大药打造,分析师预测其金额将高达100亿美元。心力衰竭的用药市场巨大,仅在美国,就有超过500万患者,预计到2030年,发病率增长50%,发病人数超过800万人;而同时LCZ-696临床优势显著,与临床广泛应用、改善生存的血管紧张素转化酶抑制剂(ACEI)依那普利(enalapril)相比,LCZ-696不仅使心血管疾病死亡率和首次住院率降低了五分之一,还降低了症状恶化、额外治疗和急诊治疗等发生率。
专利权人诺华股份有限公司2003年1月16日提交了名称为“含有缬沙坦和NEP抑制剂的药物组合物“专利申请,优先权日期为2002年1月17日,该专利是03802268.0的分案申请。并于2015年4月8日获得授权(专利号:ZL201110029600.7)。2017年4月5日被提起无效。本案列为专利复审委员会”重大案件公开审理“的第五例案件。
复审委最终宣告诺华的专利ZL201110029600.7专利权全部无效,本无效案件的基本信息如下:
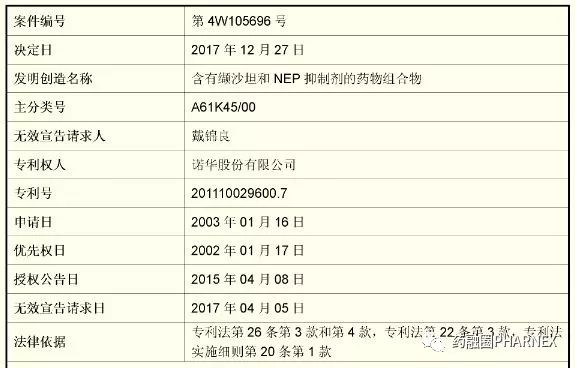
三、决定解读
① 说明书符合充分公开
请求人认为本专利解决的技术问题是提供一种具有协同效果的治疗或预防高血压等多种疾病的药物组合物。而在说明书中并未披露和记载实验方法、实验数据、用药比重等情况下“断言式结论”认为缬沙坦和中性内肽酶抑制剂可以产生协同作用,以及多种适应这个的效果,不符合专利法上充分公开的要求。
合议组认为,说明书中公开了缬沙坦具有降压作用,中性内肽酶抑制剂具有降压作用,对本领域技术人员而言,两种分别具有降压作用的化合物组和之后,在没有相反证据的情况下,其组合具有协同降压的效果具有可行性和合理性。说明书符合充分公开的要求。
本领域技术人员基于说明书记载的内容可以判断本专利所要解决的技术问题至少包括提供“一种有效治疗高血压的药物组合物“”一种具有协同作用的治疗高血压的组合物“。如果一项发明存在多个要解决的技术问题,并不要求其必须解决说明书记载的所有要解决的技术问题,只要保护了其中一个要解决的技术问题,就该技术方案而言,已经达到了充分公开的要求。
②权利要求1不具有创造性
权利要求1保护一种药物组合物,其包括(i)AT1-拮抗剂缬沙坦或其可药用盐和(ii)N-(3-羧基-1-氧代丙基)-(4S)-对-苯基苯基甲基)-4-氨基-2R-甲基乙酸乙酯或其可药用盐以及可药用载体。证据13公开了AII拮抗剂和NEP抑制剂组合物可以治疗高血压和充血性心衰,那么评价创造性的关键点就是本权利要求1的技术方案降血压方面取得的技术效果。
合议组认为,联合用药是选用高血压药物的原则之一,联合用药可以减少每一种药的用量和不良反应,并得到协同作用的效果。而要具有协同效果,并非随意的组合所能获得。因此,AT1-拮抗剂缬沙坦或其可药用盐和(ii)N-(3-羧基-1-氧代丙基)-(4S)-对-苯基苯基甲基)-4-氨基-2R-甲基乙酸乙酯或其可药用盐的组合具有协同效果需要药效试验进行证实。但是说明书和实施例并没有公开具体的实验数据或结果来证明本发明的技术方案所述组合具有意料不到的治疗效果。
对于专利权人提交的申请日后补充的实验数据,以证明高血压动物模型中具有降低平均动脉压协同作用,因为其证明的技术效果并不能再说明书中得到,因此未被接受。并且,说明书中采用的动物模型是DOCA-盐和SHR两种大鼠模型,而补交的实验数据是Dah1、SHPsp和SHR三种大鼠模型,且SHR大鼠实验并未显示组合药物的协同作用。
因此,合议组认为:本领域技术人员有动机将现有的两种具有血管紧张素Ⅱ受体拮抗剂和NEP抑制剂进行组合,其效果也是可以预期的,因此不具有创造性。
③权利要求2不具有创造性
权利要求2保护一种药物包,其在独立的容器中包含单包装的药物组合物,其在一个容器中包含含有N-(3-羧基-1-氧代丙基)-(4S)-对-苯基苯基甲基)-4-氨基-2R-甲基乙酸乙酯的药物组合物,在第二个容器中包含有缬沙坦的药物组合物。和附件13相比,权利要求2要解决的技术问题就是提供一种具有治疗高血压的药物包。而将两种联合使用的药物制成单独的包装也是本领域的常规技术手段。因此,权利要求2不具有创造性。
四、观点及启示
1、联合用药与复方制剂的专利申请
本案中,复审委认为AT1-拮抗剂缬沙坦或其可药用盐和(ii)N-(3-羧基-1-氧代丙基)-(4S)-对-苯基苯基甲基)-4-氨基-2R-甲基乙酸乙酯或其可药用盐的组合属于联合用药,联合用药的关键是协同作用的认定。主要考量指标应该是在安全和有效性方面是否具有突出的效果。例如,副作用大大降低、或者药效显著提升等等。而这些需要通过系列的实验数据来进行佐证,并最好能有对比实验。
【最高人民法院(2011)行提字第8号行政判决书】最高人民法院认为:临床联合用药与复方制剂虽属于不同的技术领域,性质有所不同,但亦具有十分紧密的联系。在临床联合用药公开了足够的技术信息的情况下,本领域技术人员能够从中获得相应的技术启示。在对比文件公开了丰富、详实的技术内容的基础上,本领域技术人员已能获得足够的启示并有足够的动机,获得涉案专利技术。其次,由于立法目的、规范对象以及具体标准均有实质性的区别,故对于涉及药品的发明创造而言,在其符合专利法中规定的授权条件的情况下,即可授予专利权,无需另行考虑该药品是否符合其他法律法规中有关药品研制、生产的相关规定。再次,专利申请人未能在专利说明书中公开的技术方案、技术效果等,一般不得作为评价专利权是否符合法定授权确权标准的依据。
笔者认为,临床用药或者复方制剂专利的申请,专利申请时间节点的选择、实验方案的设计、实验数据的表述等等,对于专利的授权前景及稳定性都有重要的意义。
2、联合用药与复方制剂的区别与认定标准
联合用药与复方制剂的区别和联系在理论和实务中未有定论。
1、《药剂学》(人民卫生出版社1986年11月出版)中记载:“在制剂生产中往往用二种或二种以上药物配成复方制剂,其目的是为了服用方便,提高疗效和减少不良反应。……在临床治疗上也经常采用合并用药的方式来提高药物的疗效或降低药物的毒副作用。
2、《药理学》中记载:“联合用药”中记载:“两种或两种以上的药物同时或前后使用称为联合用药或配伍用药。药物联合使用其药理作用加强者称为协同作用。……药物联合使用其药理作用减弱者称为对抗作用或拮抗作用。”“联合用药的目的是为了提高疗效、克服不良反应及防止某些病原体耐药性的产生,这在临床医疗中具有重要使用价值;但是不合理的联合用药,不但难以提高疗效,还可能降低疗效或出现不良反应。这是由于两种药物在吸收、分布、生物转化、排泄或药理作用等方面的相互干扰所造成的,这种相互影响称为药物的相互作用。”
3、复审委曾经在针对第8113号无效决定的答辩中认为:虽然联合用药和复方制剂是不同的概念,但是二者密切相关。联合用药是一种给药方式,包含以复方制剂的方式,二者并不具有本质区别。
3、医药专利申请时,实验数据的准备与答辩
医学和药学都属于实证性科学范畴,需要大量的实验来验证。医药领域的专利申请,也离不开大量的实验和数据。特别是对于老药新用、联合用药及复方制剂等创新领域,在撰写申请文件时详细有针对性的记载发明的有益技术效果,可以有力地证明发明技术方案的显著的进步;而当在审查过程中受到创造性质疑时,通过对发明技术效果的有效答复,可以加快推进审查过程,提高专利授权的可能性。
为了更好的获得授权,笔者认为应注意如下几点:
1、 充分的检索,尽可能获得最接近现有技术。并针对性的设计好相应的实验方案,同时基于发明的区别技术特征和该区别特征结合权利要求的其它已知特征而得到并记载明确的实验数据,增强数据对于效果的说服力;
2、 在提供对比试验数据以证明预料不到技术效果时,应证明预料不到的技术效果是发明所要保护的整个范围内都可以达到的;同时由预料不到技术效果概括得到的保护范围应当适度、合理。
4、申请日后提交的补充实验数据能否被接受问题
本案中,合议组对于申请日后提交的补充数据并未接受。尽管2017年专利审查指南增加了关于补交的实验数据的规定,指出:对于申请日后补交的实验数据,审查员应当予以审查。但是接受的条件很严格。
补交实验数据所证明的技术效果应当是所属技术领域的技术人员能够从专利申请公开的内容中得到的。因此,对于申请日后补交的实验数据,如果与本申请的公开内容一致,则应当被考虑。
该技术效果应该是说明书中有实验数据或其他证据支持的。仅仅在说明书存在简单表述,之后在答复过程中补交数据,审查员是不会予以考虑的。
笔者认为,医药专利对于医药企业的来说是非常重要的资产,而且一项发明的产生,需要科学家及技术人员通过大量的实验获得,付出的成本很高。而专利实际上是对之前所有付出及成果的汇总与保护。千万不要过于吝惜这临门一脚投入,应当精心策划、充分检索、做好战略布局、认真撰写,才能获得一件高质量的专利,成为企业真正的资本和核心竞争力。
发布:IPRdaily中文网(IPRdaily.cn)
作者:鲁礼炎 隆安(上海)律师事务所 合伙人律师 专利代理人 知识产权律师
编辑:IPRdaily赵珍 校对:IPRdaily纵横君
推荐阅读
“投稿”请投邮箱“iprdaily@163.com”

「关于IPRdaily」
IPRdaily成立于2014年,是全球影响力的知识产权媒体+产业服务平台,致力于连接全球知识产权人,用户汇聚了中国、美国、德国、俄罗斯、以色列、澳大利亚、新加坡、日本、韩国等15个国家和地区的高科技公司、成长型科技企业IP高管、研发人员、法务、政府机构、律所、事务所、科研院校等全球近50多万产业用户(国内25万+海外30万);同时拥有近百万条高质量的技术资源+专利资源,通过媒体构建全球知识产权资产信息第一入口。2016年获启赋资本领投和天使汇跟投的Pre-A轮融资。
(英文官网:iprdaily.com 中文官网:iprdaily.cn)

本文来自IPRdaily.cn 中文网并经IPRdaily.cn中文网编辑。转载此文章须经权利人同意,并附上出处与作者信息。文章不代表IPRdaily.cn立场,如若转载,请注明出处:“http://www.iprdaily.cn/”

 共发表文章4693篇
共发表文章4693篇文章不错,犒劳下辛苦的作者吧
- 我也说两句
- 还可以输入140个字













