没收到验证邮件?请确认邮箱是否正确或 重新发送邮件

#本文仅代表作者观点,不代表IPRdaily立场#
“尼洛替尼优异的市场表现和即将到来的专利悬崖引起了国内仿制药企的重点关注。”
来源:IPRdaily中文网(iprdaily.cn)
作为诺华制药现阶段CML领域的明星产品,尼洛替尼优异的市场表现和即将到来的专利悬崖引起了国内仿制药企的重点关注。诺华制药针对尼洛替尼的专利布局已相对完善,故即使基础化合物的中国专利2023年即将到期,并不意味着仿制该药物的专利侵权风险已全部解除。本文通过对该药品的全球审批信息、原研药企专利布局策略、国内仿制药申报和专利声明情况进行全面收集和多维度解读,为国内药企抓住尼洛替尼以及类似药物的仿制时机、制定合适的药品申报策略等提供思路。
导读
2018年热映电影《我不是药神》讲述了一群慢性粒细胞白血病(Chronic myeloid leukemia,简称“ CML”或慢粒)患者面对无法负担的天价药物格列宁(真实药品名是格列卫,通用名是甲磺酸伊马替尼,原研药厂家是诺华制药)寻求印度低价仿制药代购的故事,CML用药难用药贵问题引发社会热议。
CML症作为一种发生在多能造血干细胞中的恶性骨髓增殖性肿瘤,占成人白血病的15%,全球年发病率为1.6~2/10万,95%以上的CML患者均发生BCR-ABL基因融合。由于酪氨酸激酶(TKI)抑制剂可以与BCR-ABL融合基因的ATP位点结合,让CML转变成为慢性可控疾病,故以伊马替尼等为代表的TKI抑制剂被认定为治疗CML的一线用药。但基因ATP位点突变带来的TKI耐药性问题使得患者必须不断更换新一代药物,才能长期生存。
诺华制药在CML治疗领域和TKI药物研究方面具有领先优势,从2001年推出第一代TKI抑制剂伊马替尼开启CML靶向治疗的大门后,截止目前已经成功推出三代药品。
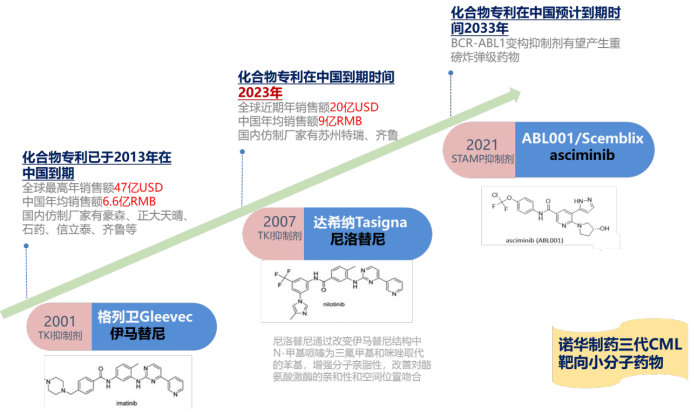
第一代药物伊马替尼(商品名:格列卫)的化合物专利已于2013年在中国到期,2017年被纳入中国医保目录,目前中国的年均销售额在6.6亿左右人民币。国内获批仿制厂家有豪森药业、正大天晴药业、石药等。
第二代药物尼洛替尼(商品名:达希纳)是伊马替尼的升级版,通过将伊马替尼结构中N-甲基哌嗪改变为三氟甲基和咪唑取代的苯基,增强了分子亲脂性,改善了对酪氨酸激酶的亲和性和空间位置吻合,用于治疗对伊马替尼耐药的CML症。尼洛替尼目前全球年销售额接近20亿美元,在中国的年销售额达到9亿人民币,其在中国的化合物专利即将于2023年到期。
第三代产品Scemblix通过对ABL肉豆蔻酰口袋(STAMP)发挥作用,可将BCR-ABL1锁定为非活性构象,帮助解决CML患者对TKI的耐药性,并克服与白血病细胞过度产生相关的缺陷型BCR-ABL1基因突变,未来有望成为重磅炸弹级药物,Scemblix于2021年底获得美国FDA批准上市,目前已经向国家药监局提交了注册申请尚未获批,其化合物专利预计到期时间是2033年。
作为诺华制药现阶段CML领域的明星产品,尼洛替尼优异的市场表现和即将到来的专利悬崖势必会引起国内仿制药企的重点关注。
1、诺华制药尼洛替尼在全球的申报/上市情况
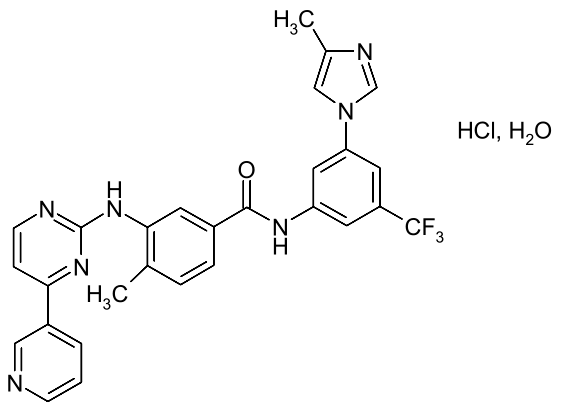
尼洛替尼化学结构式[1]
2007年10月29日,美国FDA批准诺华制药达希纳®(英文商品名Tasigna®,英文通用名称Nilotinib,中文通用名称尼洛替尼,剂量是50mg、150mg、200mg)用于治疗慢性髓细胞白血病,作为孤儿药ODE,尼洛替尼同时获得了7年的市场独占权。根据美国专利链接制度,诺华制药已在美国FDA Orange Book(橙皮书)中登记了7件专利,分别是US7169791B2、US8163904B2、US8389537B2、US8415363B2、US8293756B2、US8501760B2、US9061029B2,涉及专利类型包括基础化合物、衍生物、晶型、药物组合物和用途。且因完成了儿科研究获得PED,上述7件专利的到期时间均被延长了6个月。
并且,尼洛替尼Tasigna®于2007年先后被瑞士(7月1日)、欧盟(11月19日)批准,于2009年被日本(1月21日)、中国(7月14日)批准。
2、诺华制药尼洛替尼的专利布局策略剖析
作为对专利保护制度依存度最高的医药行业,原研药企会根据每个药物的研发进度选择合适时机申请不同类型的专利形成专利丛林,以期达成最长时间的市场垄断。为全面掌握诺华就尼洛替尼的专利布局情况,本节对全球已公开的1022件尼洛替尼相关专利进行阅读和申请人筛选,共获得诺华制药668件专利,进一步简单同族合并后获得24项PCT专利进行专利布局剖析。
2.1 全球专利布局策略

图1 诺华制药尼洛替尼相关专利布局
诺华制药在2003年申请了尼洛替尼的基础化合物专利后,又分别布局了组合物(9项)、衍生物(1项)、制剂(3项)、中间体(2项)、晶型(1项)和用途(7项)对应的专利,且专利申请周期达10年,从而有效延长了尼洛替尼的专利生命周期。
2.2 中国专利布局分析
表1 尼洛替尼中国专利布局表
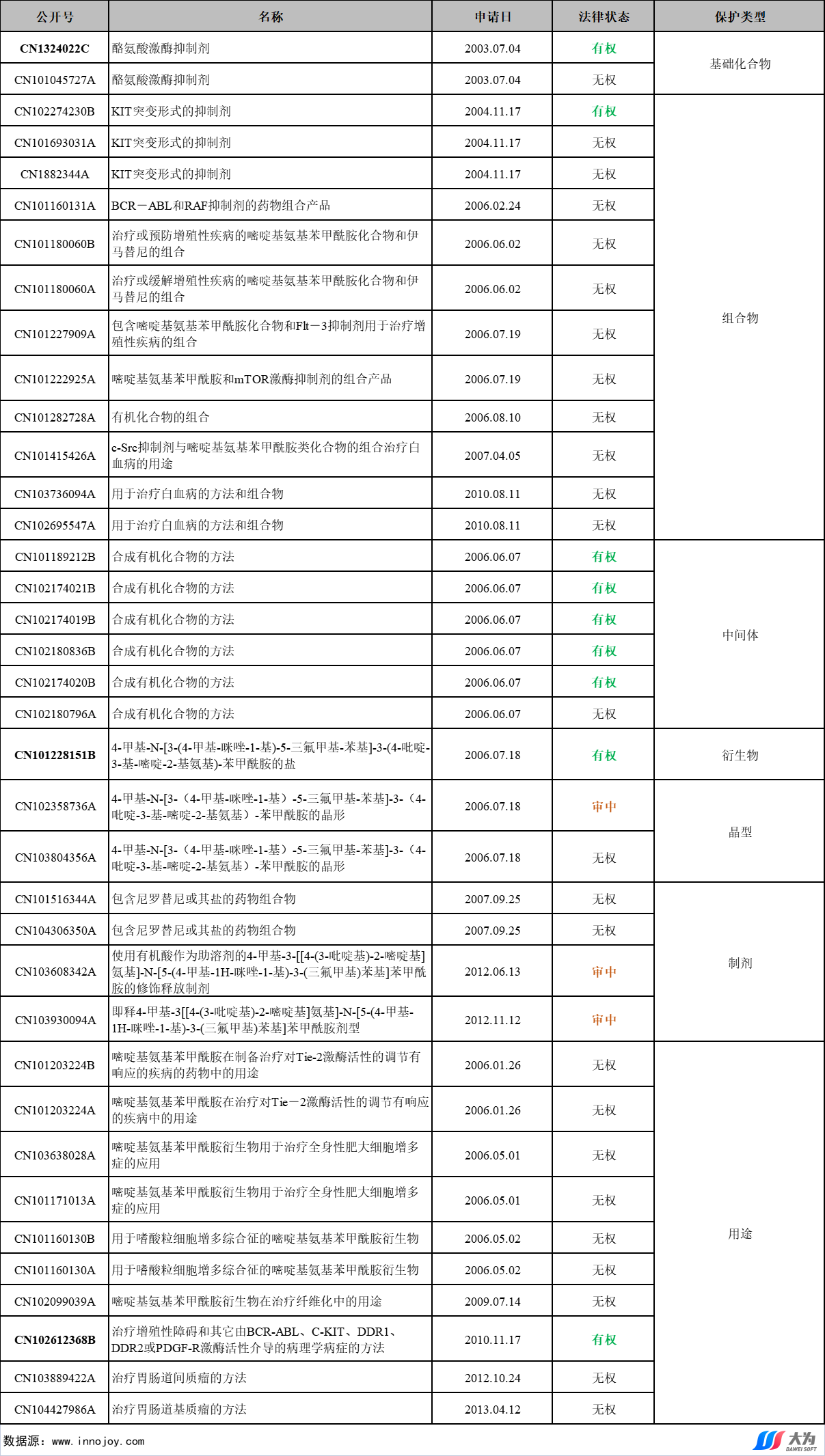
诺华制药针对尼洛替尼在中国的专利布局涵盖了基础化合物、组合物、中间体、衍生物、晶型、制剂和用途,37件专利中仅有9件处于有权状态,包括1件基础化合物、1件组合物、5件中间体、1件衍生物和1件用途专利,其中CN1324022C(基础化合物)、CN101228151B(衍生物)和CN102612368B(用途)已经被诺华制药登记在“中国上市药品专利信息登记平台”。
2.3 基础化合物专利
诺华制药尼洛替尼的基础化合物专利WO2004005281A1的中国同族是CN1324022C,申请日为2003年7月4日,正常到期时间为2023年7月4日。作为仿制药企无法规避的最重要专利,诺华制药就该专利的技术内容在全球31个国家或地区申请了53件简单同族专利,保护地域包括中国、美国、欧洲、日本、加拿大、德国、英国、西班牙、葡萄牙、韩国、澳大利亚等。
2.4 重要中间体专利
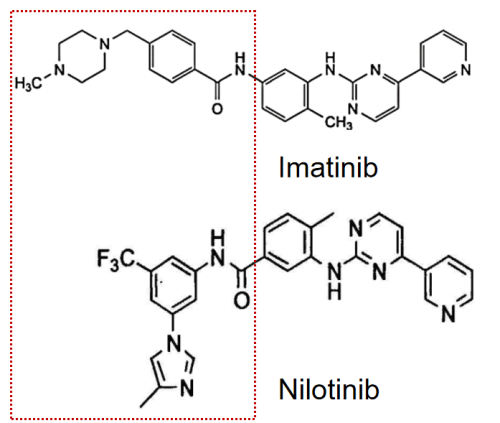
尼洛替尼与伊马替尼结构对比
尼洛替尼作为伊马替尼的升级产品,与伊马替尼的母核结构相似,仅将伊马替尼结构中的N-甲基哌嗪改变为三氟甲基和咪唑取代的苯基。诺华制药针对此处改进申请了中间体及其制备方法专利进行重点保护,对应的PCT专利为WO2006135640A2,其独权1主要保护的是5-(4-甲基-1H-咪唑-1-基)-3-(三氟甲基)-苯胺(中间体1![]() )的制备方法,该专利进入中国后被拆分成6件专利,分别是CN101189212B、CN102174020B、CN102180836B、CN102174019B、CN102174021B和CN102180796A(无权),其中CN101189212B是母案,其他是分案,均保护的是中间体1的制备工艺,具体如下:
)的制备方法,该专利进入中国后被拆分成6件专利,分别是CN101189212B、CN102174020B、CN102180836B、CN102174019B、CN102174021B和CN102180796A(无权),其中CN101189212B是母案,其他是分案,均保护的是中间体1的制备工艺,具体如下:

3、国内仿制药申报和专利声明情况
根据《药品专利纠纷早期解决机制实施办法(试行)》规定,无论原研药企还是仿制药企,都应在“中国上市药品专利信息登记平台”进行专利登记和声明[2],平台上的专利声明可以作为药品仿制信息的重要来源。
表2 尼洛替尼仿制申请汇总表
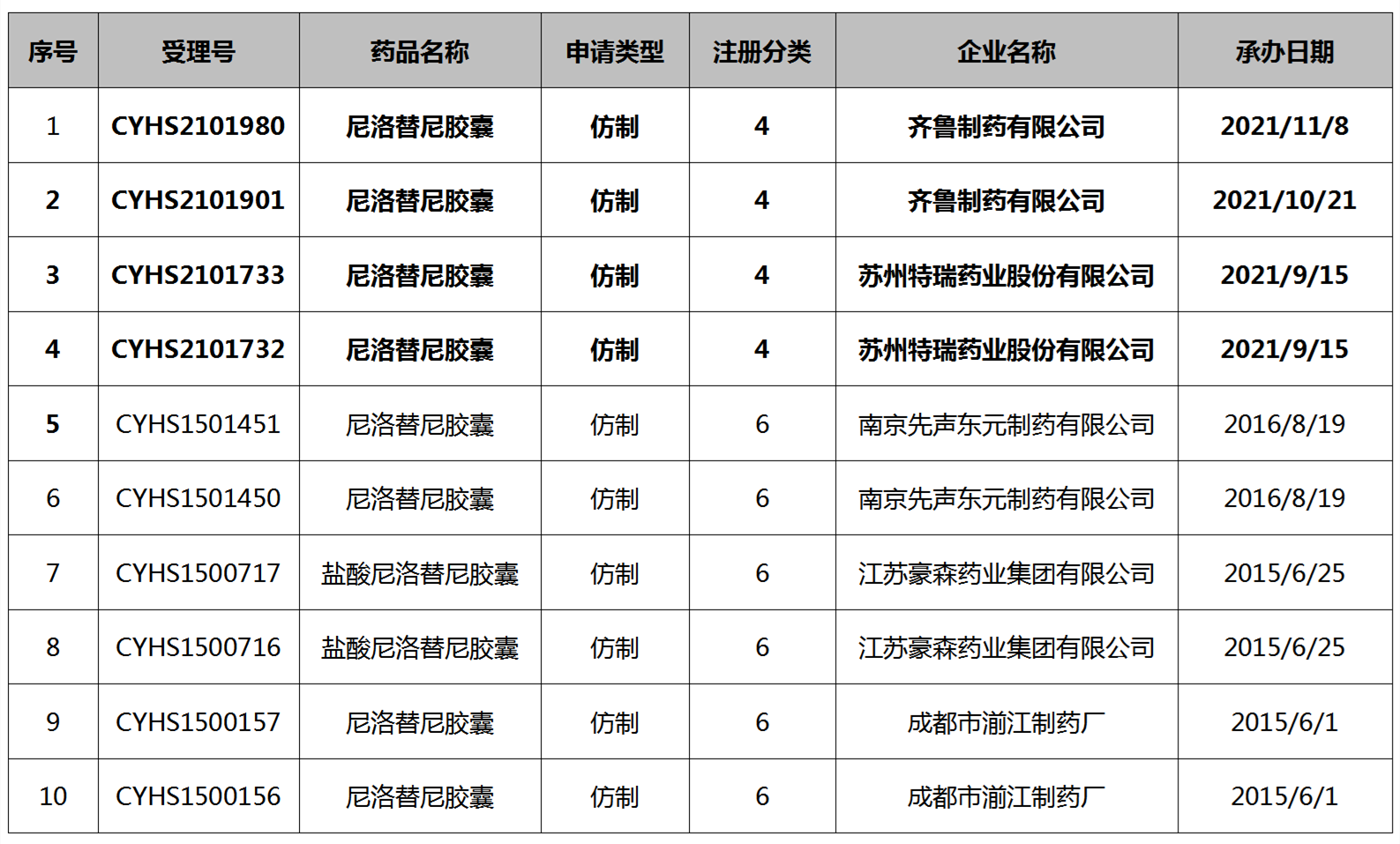
通过国家药品监督管理局药品评审中心查询,针对尼洛替尼提出仿制申请的企业主要有成都市湔江制药厂、江苏豪森药业集团有限公司、南京先声东元制药有限公司、苏州特瑞药业股份有限公司和齐鲁制药有限公司,其中在审的只有苏州特瑞药业有限公司(以下简称“特瑞药业”)和齐鲁制药有限公司(以下简称“齐鲁制药”),并且只有这两家公司在中国上市药品专利信息登记平台上作出了对应的专利声明。
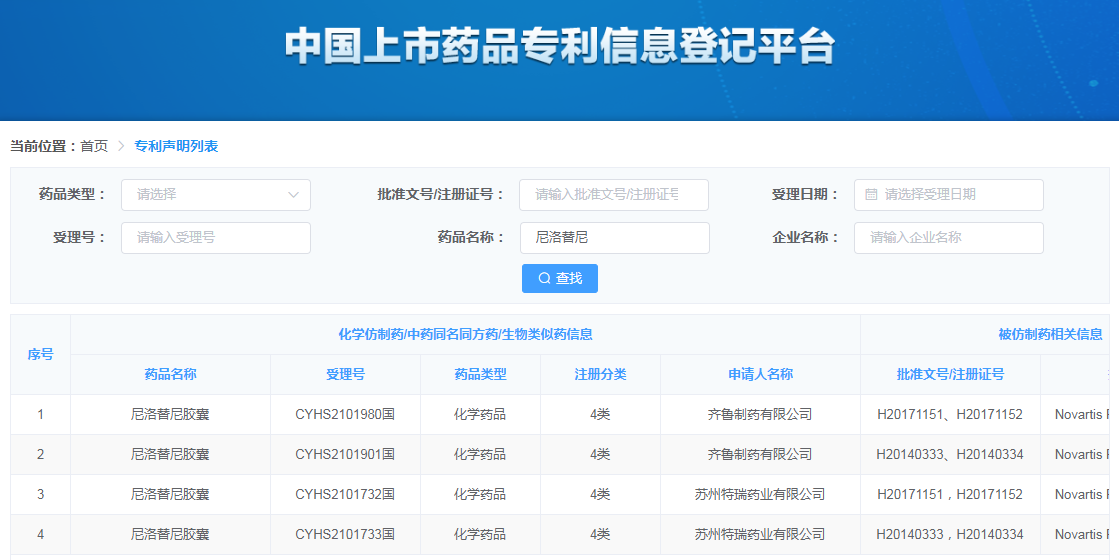

3.1 特瑞药业专利声明情况
特瑞药业于2021年9月14日针对诺华制药登记的CN1324022C(基础化合物)专利进行了3类声明,并针对CN101228151B(衍生物)和CN102612368B(用途)专利进行了4.1类声明。同时特瑞药业已经于2021年9月16日,分别对专利CN101228151B和CN102612368B提出了无效请求,根据专利复审委员会作出的无效宣告请求审查决定书,CN101228151B(CN200680026444.6)被宣告全部无效,CN102612368B(CN201080051819.0)维持专利权有效,对应的无效决定如下。

结合衍生物专利CN101228151B无效宣告请求审查决定书来看,基于专利说明书的相关记载,本专利相对于游离碱具有提高13倍的生物利用度的技术效果并未在说明书中记载,不能得出专利权利要求1所保护的尼洛替尼单盐酸盐一水合物相对于尼洛替尼的游离碱或者盐酸盐具有更好的技术效果(溶解度和特性溶出速率),不具备创造性。权利要求2保护的一种尼洛替尼单盐酸盐一水合物的制备方法相对于证据8公开的盐结晶制备方法,不具备突出的实质性特点和显著的进步。权利要求3-4相对于证据7公开的药物载体和用途,不具备突出的实质性特点和显著的进步。所以最终决定宣告此发明专利权全部无效。截止目前诺华制药暂未针对此无效诉诸法院,并且根据无效决定依据推测,即使诺华制药针对无效提起上诉,无效决定结果被推翻的几率也较低。
以上内容为仿制药企无效衍生物方面的专利提供了很好的思路,同时也提醒企业在申请专利时应当注意说明书的充分公开,即说明书中除了描述请求保护的对象本身的效果外,还要注重比较发明与现有技术的效果差异,且除了清楚记载实验方法、实验条件、实验样品和实验结果,还要提供能够证明发明所解决的技术问题和保护范围之间存在必然联系的实验证据。
如果特瑞药业的尼洛替尼仿制药首个获批上市,将会给予12个月的市场独占期,意味着在这12个月里国内市场只有特瑞药业和诺华制药的尼洛替尼胶囊。从目前已经公开的仿制药评审信息来看,特瑞药业极有可能成功获得尼洛替尼首仿。
为推进自身尼洛替尼的尽快入市,特瑞药业也及时布局了两件尼洛替尼的相关专利,均以其子公司苏州立新制药有限公司名义申请,其中一件中间体制备方法专利CN103694176B(已授权)保护了“通过在缩合反应中添加助催化剂、混合缚酸剂,优化反应温度等提高了目标产物收率”,另一件专利CN107188887A(已被驳回)试图保护杂质及制备方法。
3.2 齐鲁制药专利声明情况
齐鲁制药针对诺华制药登记的CN1324022C专利作出的也是3类声明,但是针对CN101228151B和CN102612368B专利作出的却是4.2类声明,可能是考虑到提交仿制申请和专利声明都晚于特瑞药业,获得首仿的可能性很低,所以齐鲁制药采取了相对保守的策略。截止到检索日,暂未发现齐鲁制药有尼洛替尼相关的专利被公开。

4、临期药物仿制专利须知
4.1 原研药企专利布局相对完善,仿制前应做好FTO评估
诺华制药就尼洛替尼的专利布局已经相对完善,专利类型已覆盖基础化合物、衍生物、组合物、制剂、中间体、晶型和用途等,最晚授权专利在中国到期时间是2030年11月17日。因此虽然诺华制药的基础化合物专利在中国即将到期,但并不意味着仿制该药物不存在侵犯其他专利权风险,还需要持续跟踪诺华制药和其他药企的专利布局动态,做好专利防侵权评估,同时对自身的研发成果积极申请专利进行保护,必要的时候可作为专利许可的筹码推进产品进入市场。
4.2 仿制时机和策略启示
《药品专利纠纷早期解决机制实施办法(试行)》实行以后,不论原研药企还是仿制药企,都要在“中国上市药品专利信息登记平台”进行专利登记和声明,为国内药企开展仿制工作提供了极大的便利。结合尼洛替尼的案例来看,特瑞药业和齐鲁制药都是在2021年(即在原研药企基础化合物专利到期前2年)提出仿制申请和专利声明,国内仿制药企可以适当参考。针对诺华制药的基础化合物专利CN1324022C,特瑞药业和齐鲁制药提交的都是3类声明,这是因为基础化合物保护范围很大,很难进行无效和规避,所以仿制药厂家通常承诺在相应专利权期限届满之前所生产的仿制药暂不上市。
针对诺华制药的衍生物和用途专利,特瑞药业和齐鲁制药分别采取了不同的应对策略,其中特瑞药业提交了4.1类声明并对两件专利分别提出了无效,而齐鲁制药仅提交了4.2类声明。对于技术准备充分的仿制药产品,建议企业争取首仿并提交4.1类声明,如果提交4.1类声明挑战专利成功并首个获批上市的化学仿制药将会获得12个月的市场独占期。4.2类声明(声明未落入相关专利权保护范围)须慎用,因为该声明除需要提交包括仿制药技术方案与相关专利的相关权利要求对比表及相关技术资料外,还应当向上市许可持有人在中国上市药品专利信息登记平台登记的电子邮箱发送声明及声明依据,并留存相关记录,考虑到这种行为会增加泄露技术秘密的风险,故建议只给出能够明确判断仿制药未落入相关专利权保护范围的笼统技术方案即可。
4.3 专利撰写建议
诺华制药的衍生物专利CN101228151B被成功无效的理由是权利要求得不到专利说明书的支持,建议国内药企在申请类似专利时应当注意,说明书中除了描述请求保护的对象本身的效果外,还要注重比较发明与现有技术的效果差异,另外说明书中不仅应当清楚记载实验方法、实验条件、实验样品和实验结果,而且所提供的实验证据要能够证明发明所解决的技术问题与请求保护的衍生物之间存在必然的联系。
附:数据说明
为全面获取尼洛替尼的全球专利数据,本报告以尼洛替尼的中英文名称、商品名、实验室代码、化学名称、CAS号、结构式等作为检索要素,选用美国食品药品监督局FDA网站、SciFinder Scholar、药渡数据和innojoy专利数据库等四个平台分别制定不同的检索策略,共获得原始专利数据1022件,经过人工阅读筛选和简单同族专利合并,最终得到与尼洛替尼相关的专利226项,其中诺华制药PCT专利24项(检索截止日2022年6月13日)。
专利声明类型说明:
1类:中国上市药品专利信息登记平台中没有被仿制药品相关专利信息(专利信息登记平台登记号、登记的专利号均填写“无”);2类:中国上市药品专利信息登记平台收录的被仿制药品相关专利权已终止或者被宣告无效,或者仿制药申请人已获得专利权人相关专利实施许可(在备注中注明相应的具体情形);3类:中国上市药品专利信息登记平台收录有被仿制药品相关专利,仿制药申请人承诺在相应专利权有效期届满之前所申请的仿制药暂不上市;4.1类:中国上市药品专利信息登记平台收录的被仿制药品相关专利权应当被宣告无效,4.2类:仿制药未落入中国上市药品专利信息登记平台收录的被仿制药品相关专利权保护范围。
注释:
[1]化学结构式来自于FDA上提供的尼洛替尼的LABEL information
[2]《药品专利纠纷早期解决机制实施办法(试行)》规定:“药品上市许可持有人在获得药品注册证书后30日内,自行登记药品名称、剂型、规格、上市许可持有人、相关专利号、专利名称、专利权人、专利被许可人、专利授权日期及保护期限届满日、专利状态、专利类型、药品与相关专利权利要求的对应关系、通讯地址、联系人、联系方式等内容。相关信息发生变化的,药品上市许可持有人应当在信息变更生效后30日内完成更新。”,“化学仿制药申请人提交药品上市许可申请时,应当对照已在中国上市药品专利信息登记平台公开的专利信息,针对被仿制药每一件相关的药品专利作出声明”。
版权声明:
本文为大为咨询团队原创,文章内容文字、图片和音视频资料,版权均属大为知识产权所有,任何媒体、网站或个人未经授权不得转载、链接、转贴或以其他方式复制发布/发表。已获授权的媒体、网站或个人使用时请注明"稿件来源:大为知识产权",商业使用请联系:18531281151。
(原标题:尼洛替尼专利悬崖将至,国内仿制机会如何?)
来源:IPRdaily中文网(iprdaily.cn)
编辑:IPRdaily王颖 校对:IPRdaily纵横君
注:原文链接:尼洛替尼专利悬崖将至,国内仿制机会如何? (点击标题查看原文)


「关于IPRdaily」
IPRdaily是全球领先的知识产权综合信息服务提供商,致力于连接全球知识产权与科技创新人才。汇聚了来自于中国、美国、欧洲、俄罗斯、以色列、澳大利亚、新加坡、日本、韩国等15个国家和地区的高科技公司及成长型科技企业的管理者及科技研发或知识产权负责人,还有来自政府、律师及代理事务所、研发或服务机构的全球近100万用户(国内70余万+海外近30万),2019年全年全网页面浏览量已经突破过亿次传播。
(英文官网:iprdaily.com 中文官网:iprdaily.cn)
本文来自IPRdaily中文网(iprdaily.cn)并经IPRdaily.cn中文网编辑。转载此文章须经权利人同意,并附上出处与作者信息。文章不代表IPRdaily.cn立场,如若转载,请注明出处:“http://www.iprdaily.cn

 共发表文章1873篇
共发表文章1873篇文章不错,犒劳下辛苦的作者吧
- 我也说两句
- 还可以输入140个字


















