没收到验证邮件?请确认邮箱是否正确或 重新发送邮件

#本文仅代表作者观点,不代表IPRdaily立场,未经作者许可,禁止转载#
来源:IPRdaily中文网(iprdaily.cn)
作者:卿金坚 Emma Qing 新加坡柯吴律师事务所 Quahe Woo & Palmer LLC 新加坡执业律师 中国专利代理人
原标题:仿制药与原研药的博弈——走进新加坡专利链接制度的法律与实践
2021年6月1日,专利链接制度(patent linkage)正式在中国施行。此次专利链接制度通过新修正的《专利法》第七十六条落地实施,在专利法层面设立了药品专利纠纷早期解决机制的法律依据。
纵观近30年来药品相关知识产权在中国的探索和发展,专利链接的建立与否在于政策上如何设置把握仿制药企和原研药企之间的利益平衡点,以及实操上如何建立健全与之配套的制度衔接和部门协同。随着近年来相关文件在各政府部门的相继出台,专利链接制度的确立不再是一纸空谈。如今一锤定音,将药品上市审批程序和药品专利纠纷解决程序相连接,仿制药与原研药的博弈由此踏上新起点。
同中国一样,新加坡的专利链接制度也旨在平衡原研药和仿制药之间的利益诉求,实现二者的平衡发展和共同繁荣。本文将对新加坡的专利链接制度进行介绍,然后再用一张表格比对中国、美国、新加坡三国在制度原则和实施细节上的异同。
一、新加坡专利链接制度概述
在美新自由贸易协定的影响下,新加坡于2016年引入专利链接制度,通过《保健品(治疗产品)条例2016》为原研药企提供一系列的保障。
在专利链接制度框架下,仿制药上市申请者在提交药品上市审批时,必须向新加坡卫生科学局声明:(1) 是否有与申请药品相关的处于有效期的专利;(2) 相关专利权人是否同意或默许仿制药申请人对仿制药进行注册;(3) 若不具备 (2) 所列信息,仿制药申请人是否认为相关专利无效或仿制药不会侵犯相关专利权。声明含有虚假信息的,仿制药申请人将面临高达2万新元的罚款和/或最高12个月的监禁,已获得批准上市的药品也可能会被撤销。
当仿制药申请人声明相关专利无效或仿制药不侵犯相关专利权时,卫生科学局可要求仿制药申请人向专利权人发出通知,仿制药申请人收到要求后必须向卫生科学局提供通知已发出的证明。
在收到通知后的45天内,专利权人可向法庭申请庭令禁止仿制药申请人继续药品上市审批的行为,或者向法庭或专利注册官申请宣告专利有效或专利将会被仿制药侵权,并将前述申请通知卫生科学局。
专利权人在45天期限内提出上述申请并通知卫生科学局的,卫生科学局自案件受理日起30个月内暂停仿制药的审批手续;否则,卫生科学局将继续审批仿制药的上市申请。长达30个月的等待期目的是为了让法庭或专利注册官有足够的时间审议案件。在新加坡高效的司法工作机制下,不大可能出现此类案件30个月后依然悬而未决的状况,使得仿制药申请人得以重启审批程序。若专利权人在等待期里胜诉了,卫生科学局将会拒绝批准仿制药的上市申请,仿制药申请人需等到专利快过期时再次尝试;相反,若胜诉的是仿制药申请人,其在卫生科学局的审批手续可继续进行。
虽然法规条理明晰,但实践中总会出现一些新颖有趣的问题。基于普通法系的新加坡,用判决先例给这些问题指明了答案。
1. 哪些是必须声明的相关专利?
由于新加坡没有类似美国“橙皮书”的药品信息披露平台,因此也没有明确规定何为仿制药申请人必须声明的相关专利。《保健品(治疗产品)条例2016》仅要求申请人声明是否有与申请药品相关的处于有效期的专利(“whether a patent under the Patents Act (Cap. 221) is in force in respect of the therapeutic product”)。
再者,由于工艺专利在美国是被明确排除在“橙皮书”之外的,具有美国“血缘”的新加坡专利链接制度该如何解读相关专利、相关专利是否包括工艺专利等议题曾在数个案例中引起讨论。终于在2020年,新加坡上诉庭就此问题给出了明确答复。
在Zyfas Medical Co v Millennium Pharmaceuticals, Inc. [2020] SGCA 84中,新加坡最高法院上诉庭明确了工艺专利也属于必须声明的专利类别。理由在于:首先,《保健品(治疗产品)条例2016》明文规定“专利”意指《专利法》中的专利,而《专利法》中的专利包括工艺专利;其次,将工艺专利包含在内符合《保健品(治疗产品)条例2016》该条目的立法目的,即应无差别地给予产品专利权人和工艺专利权人等同的通知和保护,没有理由在二者间厚此薄彼。鉴于此,上诉庭认为:如果申请上市的治疗产品中的活性成分可以使用某工艺专利制造,那么该工艺专利就属于相关专利,仿制药申请人必须予以声明。
虽然上诉庭的判决为法条解读扫清了障碍,却也引出了新的问题。由于工艺专利涵盖的药品制备方法非常广泛,潜在的可以制造出治疗产品中活性成分的工艺专利的数量可能非常庞大,仿制药申请人在试图查找识别相关专利时可能会面临较大的困难。加之“橙皮书”的缺失,仿制药申请人只能在知识产权局的专利登记册搜索是否存在与仿制药相关的专利信息,这无形中更加重了仿制药申请人的负担。由此可见,在现行制度下,天平似乎更偏向于原研药企。
2. 侵权证据不全时,专利权人是否仍可启动专利链接?
在为期45天的异议期里,专利权人需要决定是否提起侵权之诉。通常,确认是否侵权涉及调查、取证、分析等一系列步骤,45天可能并不足以作出侵权评估。特别是当侵权对象是工艺专利的时候,专利权人很难从公开渠道获悉仿制药申请人是否采用了其获专利保护的制备方法。此时,专利权人是否仍可借助专利链接制度提起侵权之诉呢?
新加坡高庭在AstraZenaca AB v Sanofi-Aventis Singapore Pte Ltd [2012] SGHC 16和AstraZeneca AB v Sanofi-Aventis Singapore Pte Ltd [2013] SGHCR 7作出了澄清。高庭认为,专利权人可以在不清楚仿制药是否会侵犯其专利的情况下提起诉讼,但进一步的证据必须在诉讼期间通过证据开示或自愿披露的方式获得。
高庭意识到30个月的等待期有可能会被专利权人滥用,达到专利权人遏制竞争对手制造、进口和销售药品等商业活动的目的,从而过度阻碍公众购买便宜的仿制药。因此,高庭要求专利权人应在其索偿书中尽可能详尽地陈述侵权事实。
二、中美新三国专利链接制度对比
(注:由于篇幅有限,关于美国的专利链接制度仅讨论适用于化学药品的Hatch-Waxman法案,对于适用于生物制品的Biologics Price Competition and Innovation Act不做探讨。)
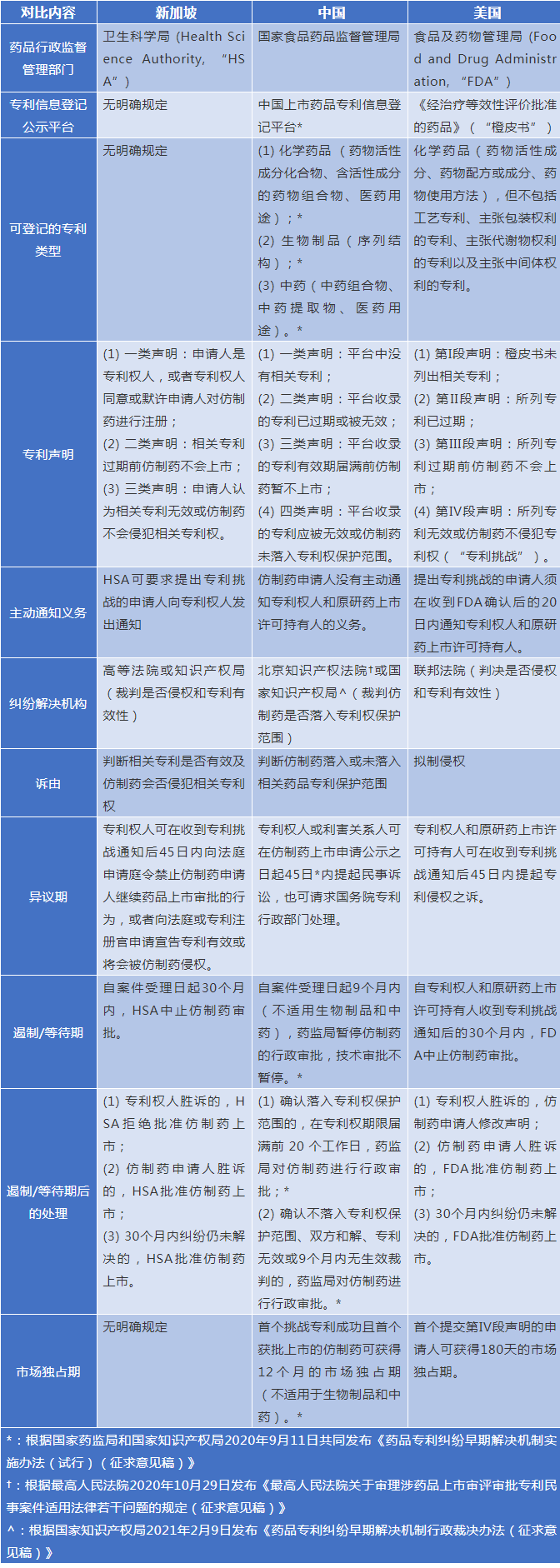
从制度框架上看,三国的专利链接制度原则上一致,只是在实施细节上各有不同。然而,这些细节上的差异恰恰反映出各国对外来制度并非照单全收的态度,而是在结合自身国情的基础上有所取舍和侧重,在原研药和仿制药的博弈里做好“端水”的角色,达到鼓励科学创新和维护公共利益的相对平衡。
比如,中国拟制的仿制药审批等待期只有9个月,相比于美国和新加坡的30个月要短得多,而上市后12个月的市场独占期也是三个国家中最长的。在中国,仿制药申请人无需通知专利权人和原研药上市许可持有人,专利权人和原研药上市许可持有人必须密切关注国家药监局公示的仿制药申请和声明;而美新两国都有通知的规定,从一定程度上降低了权利人的维权成本。同时,美国的拟制侵权制度将提交仿制药上市许可申请本身即视为侵权行为,把举证责任移转给了仿制药申请人。
种种迹象表明,作为专利链接的鼻祖,美国给予原研药企的保护更广泛更深入,在遏制仿制药上市方面更有力,原研药企较仿制药企拥有更多的政策利好。中国由于仿制药市场规模较大,在立法实践中稳妥推进专利链接制度建设势必是个循序渐进的过程。新加坡则介于两者之间,更趋于维护专利权人的利益。
相关阅读:
此“系列” 非彼“系列”—— 走进新加坡系列商标的法律与实践
来源:IPRdaily中文网(iprdaily.cn)
作者:卿金坚 Emma Qing 新加坡柯吴律师事务所 Quahe Woo & Palmer LLC 新加坡执业律师 中国专利代理人
编辑:IPRdaily王颖 校对:IPRdaily纵横君
注:原文链接:仿制药与原研药的博弈——走进新加坡专利链接制度的法律与实践(点击标题查看原文)
青年有为!寻找2021年“40位40岁以下企业知识产权精英”活动正式启动

「关于IPRdaily」
IPRdaily是具有全球影响力的知识产权媒体,致力于连接全球知识产权与科技创新人才。汇聚了来自于中国、美国、欧洲、俄罗斯、以色列、澳大利亚、新加坡、日本、韩国等15个国家和地区的高科技公司及成长型科技企业的管理者及科技研发或知识产权负责人,还有来自政府、律师及代理事务所、研发或服务机构的全球近100万用户(国内70余万+海外近30万),2019年全年全网页面浏览量已经突破过亿次传播。
(英文官网:iprdaily.com 中文官网:iprdaily.cn)
本文来自IPRdaily中文网(iprdaily.cn)并经IPRdaily.cn中文网编辑。转载此文章须经权利人同意,并附上出处与作者信息。文章不代表IPRdaily.cn立场,如若转载,请注明出处:“http://www.iprdaily.cn/

 共发表文章7603篇
共发表文章7603篇文章不错,犒劳下辛苦的作者吧
- 我也说两句
- 还可以输入140个字